下列实验操作不能达到预期实验目的的是
| |
实验目的 |
实验操作 |
| A |
鉴别Na2SO4和Na2SO3 |
加入HCl和BaCl2溶液 |
| B |
比较Fe和Cu的金属活动性 |
分别加入浓硝酸 |
| C |
比较H2O和乙醇中羟基氢的活泼性 |
分别加入少量Na |
| D |
比较I2在H2O和CCl4中的溶解度 |
向I2水中加入CCl4,振荡 |
丙酮是一种常用的有机溶剂,可与水以任意体积比互溶,密度小于1 g/mL,沸点约55 oC,分离水和丙酮时最合理的方法是
| A.蒸发 | B.分液 | C.过滤 | D.蒸馏 |
关于氧化还原反应,下列说法正确的是
①氧化剂发生氧化反应;②氧化剂具有氧化性;③氧化反应的本质是化合价升降;
④物质所含元素化合价变化是判断氧化还原反应的依据;
⑤氧化还原反应的任一反应物不是氧化剂就是还原剂
| A.②④ | B.②③④ | C.①②④ | D.①②④⑤ |
下列图示实验操作正确的是‘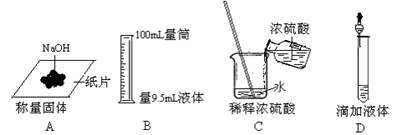
下列行为中符合安全要求的是
| A.在汽车加油站见到的油罐车上贴有如图的标志 |
| B.节日期间,在开阔的广场燃放烟花爆竹 |
| C.用点燃的火柴在液化气钢瓶口检验是否漏气 |
| D.进入煤矿井时,用火把照明 |
在10L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
| 实验 |
温度/℃ |
起始时物质的量/mol |
平衡时物质的量/mol |
|
| n(X) |
n(Y) |
n(M) |
||
| ① |
700 |
0.40 |
0.10 |
0.090 |
| ② |
800 |
0.10 |
0.40 |
0.080 |
| ③ |
800 |
0.20 |
0.30 |
a |
| ④ |
900 |
0.10 |
0.15 |
b |
下列说法正确的是
A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率v(N)=1.0×10-2mol/(L·min)
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060