恒容容器中反应:A(g)+3B(g) 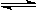 2C(g)+3D(g),达到平衡的标志是
2C(g)+3D(g),达到平衡的标志是
①体系的压强不再改变 ②混合气体的平均相对分子质量不再改变 ③各组分的浓度不再改变 ④混合气体的密度不变 ⑤反应速率vA: vB: vC: vD=1:3:2:3 ⑥单位时间内1 mol A断键反应,同时2 mol C也断键反应
| A.②③⑤⑥ | B.②③④⑤ | C.①④⑤⑥ | D.①②③⑥ |
向体积都为1L,pH都等于2的盐酸和醋酸溶液中投入0.65gZn,则下图中比较符合客观事实的曲线是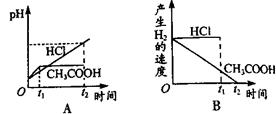
恒温条件下,在CH3COONa的稀溶液中分别加入下列的物质,能使c(CH3COO—)/c(Na+)比值一定增大的是
| A.固体NaOH | B.固体KOH | C.固体NaCl | D.冰醋酸 |
在常温下Cu(OH)2的Ksp=2×10-20。某CuSO4溶液中c(Cu2+)=0.02mol/L,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液来调整溶液的pH,应该使溶液的pH大于
| A.8 | B.9 | C.4 | D.5 |
下列叙述中,不符合生产实际的是
| A.电解法精炼铜,用纯铜做阴极 |
| B.电解熔融的氧化铝制取金属铝,用铁做阳极 |
| C.电解饱和食盐水,用碳网做阴极 |
| D.在镀件上镀锌,用锌做阳极 |
将Mg条、Al条平行插入一定浓度的NaOH溶液中(如图所示连接)。此电池工作时,下列叙述正确的是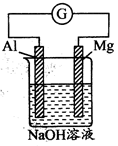
| A.Mg比Al活泼,失去电子被氧化成Mg2+ |
| B.Al条在反应中逐渐变细 |
| C.该电池的外电路中,电子由Mg极流出,Al极流入 |
| D.消耗24gMg,电路中将转移2mol电子 |