根据下列化学方程式:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O、2FeCl2+Cl2=2FeCl3、2FeCl3+2KI=2FeCl2+2KCl+I2,判断各物质氧化性由大到小的顺序正确的是
| A.I2>Cl2>FeCl3>KMnO4 | B.KMnO4 >Cl2>FeCl3>I2 |
| C.Cl2>I2>FeCl3>KMnO4 | D.FeCl3>KMnO4>Cl2>I2 |
下列关于仪器使用的说法不正确的是 ( )
| A.冷凝管的冷凝水下进上出 |
| B.锥形瓶用作反应容器时一定不能加热 |
| C.蒸馏时温度计水银球位于蒸馏瓶支管口处 |
| D.振摇分液漏斗时应关闭其玻璃塞和活塞 |
下表为各物质中所含有的少量杂质以及除去这些杂质应选用的试剂或操作方法。正确的一组为 ( )
| 序号 |
物质 |
杂质 |
除杂应选用的试剂或操作方法 |
| ① |
KNO3溶液 |
KOH |
加入FeCl3溶液,并过滤 |
| ② |
FeSO4溶液 |
CuSO4 |
加入过量铁粉,并过滤 |
| ③ |
H2 |
CO2 |
通过盛有NaOH溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
| ④ |
NaNO3固体 |
CaCO3 |
溶解、过滤 、蒸发 |
A.①②③④ B.③④ C.②③④ D.①②③
从海带中提取碘的实验过程中,涉及下列操作,其中正确的是 ( )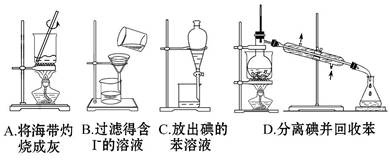
下列分离混合物的方法中,不正确的是 ( )
| A.从酒精和乙酸混合物中分离酒精——蒸馏法 |
| B.使浑浊的食盐水变澄清——过滤法 |
| C.从溴水中分离溴——分液法 |
| D.把硝酸钾和氯化钾从同一溶液中分离开来——结晶法 |
下列混合物的分离和提纯方法中,主要是从溶解性的角度考虑的是 ( )
①蒸发②蒸馏③过滤④萃取
| A.①② | B.②④ | C.③④ | D.①③ |