为鉴别Na2CO3和NaHCO3两种白色固体,有4位同学分别设计了以下四种不同的方案,
其中方法和现象判断正确的是
| A.分别加入1mol/L的盐酸溶液,看有无气泡产生 |
| B.分别取样配成溶液,滴加Ca(OH)2溶液,观察有无白色沉淀 |
| C.用铂丝蘸取固体在酒精灯火焰上灼烧,观察火焰的颜色 |
| D.分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 |
一种新燃料电池,一极通入空气,另一极通入丁烷气体,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体(在熔融状态下能传导O2-)。下列对该燃料电池说法正确的是( )
| A.在熔融电解质中,O2-由负极移向正极 |
B.电池的总反应是2C4H10+13O2 8CO2+10H2O 8CO2+10H2O |
C.通入空气的一极是负极,电极反应为O2+4e- 2O2- 2O2- |
D.通入丁烷的一极是正极,电极反应为C4H10+13O2- 4CO2+5H2O+26e- 4CO2+5H2O+26e- |
利用合成气(H2+CO)生产汽油、甲醇和氨等已经实现了工业化,合成气也可转化成醛、酸、酯等多种产物。下列表述正确的是( )
①以合成气为原料的反应都是化合反应 ②改变合成气中CO与H2的体积比,可以得到不同产物 ③合成气的转化反应需在适当的温度和压强下通过催化完成 ④从合成气出发生成液态烃或醇类有机物是实现“煤变油”的有效途径 ⑤以合成气为原料的反应产物中不可能有烯烃或水
| A.①②④ | B.②③④ | C.②④⑤ | D.③④⑤ |
氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为
H2(g)+1/2O2(g)====H2O(l);
ΔH="-285.8" kJ·mol-1
CO(g)+1/2O2(g)====CO2(g);
ΔH="-283.0" kJ·mol-1
C8H18(l)+25/2O2(g)====8CO2(g)+9H2O(l);
ΔH="-5" 518 kJ/mol
CH4(g)+2O2(g)====CO2(g)+2H2O(l);
ΔH="-890.3" kJ·mol-1
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是( )
| A.H2(g) | B.CO(g) | C.C8H18(l) | D.CH4(g) |
根据下图把煤隔绝空气加强热,下列叙述错误的是( )
| A.图中发生了化学变化 |
| B.X水溶液的pH>7;Y是一种黑色黏稠液体 |
| C.气体Z易燃,可还原CuO,也可使溴水褪色 |
| D.试管A中产生浓的白色烟 |
目前人们正在研究开发一种高能电池——钠硫电池,它是以熔融的钠、硫为两极,以Na+导电的β′Al2O3陶瓷作固体电解质,反应如下:
2Na+xS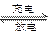 Na2Sx
Na2Sx
以下说法,正确的是( )
| A.放电时,钠作正极、硫作负极 |
| B.放电时,钠极发生还原反应 |
| C.充电时,钠极与外接电源正极相连,硫极与外接电源负极相连 |
D.充电时,阳极发生的反应是: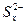  xS+2e- xS+2e- |