(10分)
(1) 已知:0.4 mol液态肼(N2H4)与足量的液态双氧水反应,生成氮气和水蒸气,放出256.65 kJ的热量.
①反应的热化学方程式为:____________________________________________.
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______________________________________________________________.
(2)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-a kJ/mol
途径Ⅱ:C3H8(g)===C3H6(g)+H2(g) ΔH=+b kJ/mol
2C3H6(g)+9O2(g)===6CO2(g)+6H2O(l) ΔH=-c kJ/mol
2H2(g)+O2(g)===2H2O(l) ΔH=-d kJ/mol
请回答下列问题:
①等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量________(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量.
②C3H8(g)===C3H6(g)+H2(g)的反应中,反应物具有的总能量________(填“大于”、“等于”或“小于”)生成物具有的总能量,.
③b与a、c、d的数学关系式是_____________________________________.
已知碱金属的氧化物有:普通氧化物,如Li2O;过氧化物,如Na2O2;超氧化物,如KO2;臭氧化物,如RbO3,其中后三者均能与H2O或CO2反应产生O2。
(1)宇航工业,为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的探索,有的科学家提出了“金属过氧化物处理系统”。即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。每个宇航员平均每天需要消耗0.9 kg氧气,呼出1.0 kg二氧化碳。有关反应的化学方程式为、;将处理后的气体充入座舱时,为了能保持飞船座舱内空气成分的稳定,还应采取的措施是___________________________________。
(2)人体内O2—离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方程式:O2— + H2O =H2O2+O2+
(3)Na2O2、K2O2、CaO2以及Ba O2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是(写电子式)
O2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是(写电子式)
(4)高温下,超氧化钾晶体 呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则每个超氧化钾晶胞含有个K+和个O2-;该晶体中,0价氧原子与-2价氧原子的数目比为
呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则每个超氧化钾晶胞含有个K+和个O2-;该晶体中,0价氧原子与-2价氧原子的数目比为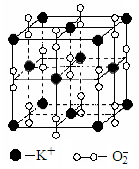
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此判断:
(1)固体B所含物质的化学式为;
(2)固体E所含物质的化学式为;
(3)反应①的离子方程式为。
有一无色溶液,可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示: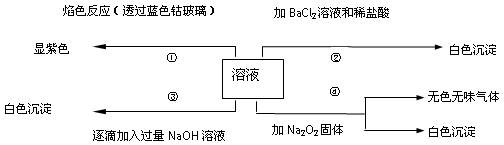
在第③个实验中,生成白色沉淀的量与加入NaOH的量有下图所示的相互关系。据此可知: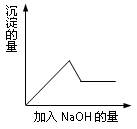
⑴在原溶液中一定不存在的离子有_____________________。
⑵为满足该溶液中一定存在的离子的要求,一般可溶解两
种常见物质为(写化学式)___________和_________。
⑶写出第③个实验中发生反应的离子方程式
。
以下三例是常见的化学实验:
①CO2通入澄清的石灰水,溶液先浑浊后澄清;
②将稀盐酸逐滴滴入Na2CO3溶液,开始时无现象,后产生气体;
③将NaOH溶液逐滴滴入AlCl3溶液,先产生白色沉淀,后沉淀消失;
回答下列问题:
(1)每例中均可用前后两个化学方程式来说明变化的规律,试用简要文字,说明这两个反应间的关系:
(2)每例中若要保证后一个反应发生,必须具备的条件是什么?
。
(3)将各例中前后两个反应方程式叠加,写出一个总的方程式。
。
硫酸亚铁是一种可用于治疗缺铁性贫血的药剂,而硫酸铁则无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用。
如果药片已经失效,应如何检验?写出主要步骤和现象
。