A、B、C、D、F属于元素周期表中的短周期元素,并且其中只有一种金属元素。A是元素周期表所有元素中原子半径最小的;B和C原子都只有两个电子层,B原子的一个电子层了电子数是另一层的两倍;C的原子的两层电子数之和是两层电子数之差的两倍;D原子的一个电子层的电子数是另两层电子数之和;E的+1价阳离子与C的阴离子有相同的电子层结构。请按要求同答下列问题:
(1)D元素在元素周期表中的位置是 ,写出由A和C组成的原子个数比为1:1的化合物的电子式 。
(2)由上述元素组成的化合物中属于直线型分子是 (只要求写出两种,用化学式表示)。
(3)上述元素形成的化合物中通常能污染空气的是 (至少写出两种),其中有两种污染物有同种元素并能相互反应,该反应的化学方程式为 。反应中氧化产物与还原产物的物质的量之比是 。
(4)写出由B、C、E三种元素组成两种氧化物互相反应有气体生成的化学方程式 ;
(5)由A、B、C、E四种元素形成的化合物的水溶液与过量石灰水反应的离子方程式是: 。
(6分)写出下列叙述中有关物质的结构简式
(1)分子式为C3H7Br的卤代烃经消去反应后得到的有机物是___________;
(2)能与金属钠反应,但不能与氢氧化钠反应的芳香族化合物C7H8O是_________;
(3)含C、H、O三种元素的有机物,燃烧时消耗的氧气和生成的CO2、H2O之间物质的量之比为1:2:2,则符合条件的有机物中最简单的一种是________________
下列物质的转化或分离是用哪种方法实现的?
| A.溶解 | B.裂解 | C.分馏 | D.裂化 |
E.干馏 F.蒸馏 G.电解 H.过滤
I.萃取 J.渗析K.盐析
请将所选方法的字母代号填在横线上(每一项只填写一种最主要的方法,用字母填空)。
(1)把煤转化为焦炉气、煤焦油和焦炭等
(2)除去粗盐溶液中的泥沙
(3)从海水得到的无水MgCl2中提取金属镁
(4)从碘水中提取碘
(5)获得短链不饱和烃,如乙烯、丙烯、丁二烯等
(6)除去淀粉溶液中所含的食盐
以海水中常见物质A为原料可以发展很多种工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题: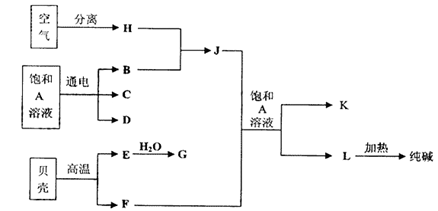
(1)电解A溶液反应的离子方程式为 ;
(2)写出C与D制取消毒剂的化学方程式 ;
(3)若要使工业合成J反应的平衡向生成J的方向移动,可采取的措施有
A.升高温度 B.增大压强 C.使用催化剂 D.液化分离J
(4)将F和J通入A的饱和溶液中的顺序为
A.先通入F后通入J B.先通入J后通入F
C.同时通入 D.没有先后顺序要求
|
(5)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。
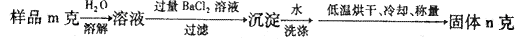
(8分) ABCDE五种物质中含有同一种元素,其相互转化关系如图所示。C是空气污染物。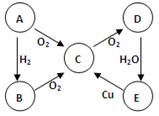
(1)如果A是淡黄色固体单质:(以下均写化学式)则C是 E是 。
写出:E→C的化学方程式
(2)如果A是无色气体: E→C的化学方程式为
(8分)在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
| C |
D |
||||||||
| A |
B |
E |
F |
(1)画出E的原子结构示意图;
(2)写出C的最高价氧化物的电子式;
(3)A最高价氧化物的水化物的化学式。
(4)元素D和元素F的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式。