水热法制备Fe3O4纳米颗粒的反应为3Fe2+ + 2S2O32-+ O2 +xOH-=Fe3O4 + S4O62- + 2H2O,
下列说法中不正确的是
| A.每生成1 mol Fe3O4,反应转移的电子总数为4 mol |
| B.Fe2+和S2O32-都是还原剂 |
| C.1 mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3 mol |
| D.x=4 |
元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语。下列有关化学用语的表示方法中错误的是
A.异丁烷的结构式: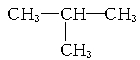 |
B.S2-的结构示意图: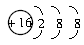 |
C.O—18的原子符号: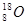 |
| D.CO2分子的结构式:O=C=O |
已知下列各组原子序数,其中能形成X2Y5型化合物的是
| A.17和13 | B.7和8 | C.15和17 | D.12和19 |
从原子序数11依次增加到17,下列所述递变关系中,错误的是:
| A.电子层数逐渐增多 |
| B.最高价氧化物的水化物的碱性减弱,酸性增强 |
| C.最高正化合价数值逐渐增大 |
| D.从硅到氯,最低负化合价从-4到-1 |
在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是
| A.正极发生得电子的氧化反应 | B.电子通过导线由铜片流向锌片 |
| C.正极有O2逸出 | D.铜片上有H2逸出 |
下列含有非极性键的化合物是:
| A.MgCl2 | B.Na2O2 | C.H2O | D.N2 |