空气是一种重要资源,空气质量成为人们日益关注的话题。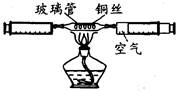
(1)利用如图装置可以测定空气中氧气的含量。实验测得空气
中氧气的体积分数为18.2%,请分析该实验出现误差的原因:
。(写一点)
(2)某工业城市空气中二氧化碳含量偏高,其原因可能是 。为了减缓二氧化碳使全球变暖的趋势,有科学家提出大胆设想:将二氧化碳压缩使其液化,然后将其压入到冰冷的深海中。但也有科学家担心海水中富含二氧化碳后酸度会增加,可能会杀死一些海洋生物,产生其他环境问题等。二氧化碳在深海中的溶解度和在通常状况下的水中的溶解度相比较,是 (填“较大”、“相等”或“较小”)。
(3)经测定该城市某次降雨的pH约为5,该次降雨 (填“是”或“不是”)酸雨,造成该城市空气污染的有害气体主要是 (写一种气体即可)。
(4)空气污染的一个主要来源是汽车的尾气排放。现用纳米级的某种氧化物做催化剂,使汽车尾气中的两种有毒气体CO和NO反应转化为两种无毒气体,其中一种是空气中含量最高的气体。生成的这两种气体是 和 。
(12分)实验室用98%的浓硫酸配制成稀硫酸,并与锌粒反应制取氢气。
(1)查阅资料。
20℃时不同质量分数硫酸的密度(g/mL)
| 质量 分数 |
0% (纯水) |
1% |
4% |
10% |
16% |
24% |
32% |
36% |
44% |
49% |
60% |
98% |
| 密度 |
1.00 |
1.01 |
1.02 |
1.07 |
1.11 |
1.17 |
1.24 |
1.27 |
1.34 |
1.39 |
1.50 |
1.84 |
分析以上数据,可以得出结论(写2条)
①;
②;
(2)计算。配制200g24.5%的稀硫酸,需g98%浓硫酸和g水。实际操作时,取98%浓硫酸mL(精确到1mL);
(3)配制稀硫酸。分别用量筒量取所需水和浓硫酸,先将倒入烧杯中,然后
;
(4)制取氢气。
①下图中可用于制取、收集氢气的装置是(填字母);
②检验氢气纯度的方法如图所示,标明氢气不纯的现象是。
(7分)某同学设计下表所示实验,探究金属铜对H2O2分解速率的影响。
| 操作 |
装置 |
 现象 现象 |
| 1、取一小块铜丝网,卷成筒形,固定在铜丝上。 |
 |
|
| 2、分别向①和②中注入15mL、30%的H2O2,并放入盛有热水的③中。 |
 |
约1min后可观察到① 和②中都有少量气泡产生 |
| 3、把铜丝插入①中。 |
 |
①中有大量气泡产生,约5min后不再有气泡产生;此时②中 仍然有少量气泡产生 |
回答下列问题:
(1)仪器的①名称是______________,仪器③的名称是______________;
(2)仪器②中实验的目的是;
(3)根据上述实验,可以得出的结论是;
(4)如果用本实验探究铜是不是H2O2分解的催化剂,需要对上述实验方案进行补充,其中必要的是________。
A.称量实验前铜丝网的质量
B.将实验后的铜丝网干燥、称重
C.向仪器中加入二氧化锰
D.将实验后的铜丝网插入AgNO3溶液中
兴趣小组同学为了弄清即将维修的沼气池中气体的成分,进行了有关实验。请你与他们一起完成以下探究活动:
【收集气体】将不加盖的矿泉水瓶装满水,用细绳吊入池中,再用木棍拨动使瓶中的水全部倒出(见右图),然后迅速拉起矿泉水瓶,盖上瓶盖。这种方法属于集气法。
 |
【对气体猜想】
猜想Ⅰ.全部是CH4;猜想Ⅱ.全部是CO;
猜想Ⅲ.全部是CO2;猜想Ⅳ.是CH4和CO2的混合气体。
【实验和推断】
(1)若“现象a”为石灰水变浑浊,则说明气体中含有气体。
(2)步骤②的目的是;步骤③“注水装置”应选右图中的(填序号)。
(3)若“现象b”为杯壁有水雾出现,有同学认为“猜想Ⅰ或Ⅳ”成立,其反应方程式为:
;另有同学认为此现象不能证明收集到的气体中一定含有氢元素,理由是;要排除这种干扰可采取的措施是。
(4)采取(3)中的排除干扰措施后:若“现象a、b”无明显现象,“现象c”石灰水变浑浊,则证明“猜想”成立;若“现象a、c”均为石灰水变浑浊,“现象b”为杯壁有水雾,则证明“猜想”成立。
(12分)现有下列仪器或装置,请回答下列问题:
|
(1)仪器①的名称 ;加热高锰酸钾制取氧气应选装置 (填字母),收集O2应采取 法。
(2)草酸(H2C2O4) 固体在浓硫酸作用下发生反应: H2C2O4======CO2↑+CO↑+H2O,若用该反应来制取CO,制气装置应选 (填字母);除去其中的CO2可选仪器AC,C中装入的试剂最好是 (填小写字母): a. 烧碱溶液 b. 浓硫酸 c. 澄清石灰水。
小青看见爸爸种花时把草木灰洒在花盆中作肥料,她查阅资料得知草木灰的主要成分是一种含钾的化合物。于是她取一些草木灰做了以下实验,请你帮助她将下列实验报告填写完整:
| 实验序号 |
实验目的 |
实验方案 |
实验现象 |
结论 |
| 实验1 |
 |
① ② |
草木灰的主要成分是碳酸钾 |
|
| 实验2 |
探究碳酸钾的性质 |
向碳酸钾溶液中滴入澄清石灰水 |
有白色沉淀生成 |
化学方程式为 |
| 实验3 |
探究实验2反应后上层清液中溶质的成份 |
上层清液中有两种溶质和 |
[反思]实验过程中产生的废液必须处理后再排放。请你对实验2反应后产生的废液处理提出可行的方法。