(14分)短周期主族元素A、B、C、D、E原子序数依次增大 , A是元素周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数。
⑴A、C、D形成的化合物中含有的化学键类型为 。
⑵已知:
① E-E→2E H=+a kJ/mol;
② 2A→A-A H=-b kJ/mol;
③ E+A→A-E H=-c kJ/mol;
写出298K时,A2与E2反应的热化学方程式 。
⑶在某温度下容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g) H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 |
甲 |
乙 |
丙 |
| 初始投料 |
2 mol A2、1 mol BC |
1 mol X |
4 mol A2、2 mol BC |
| 平衡时n(X) |
0.5 mol |
n2 |
n3 |
| 反应的能量变化 |
放出Q1kJ |
吸收Q2kJ |
放出Q3kJ |
| 体系的压强 |
P1 |
P2 |
P3 |
| 反应物的转化率 |
 1 1 |
 2 2 |
 3 3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则A2的平均反应速率
v (A2)= 。
② 计算该温度下此反应的平衡常数K = 。
③三个容器中的反应分别达平衡时下列各组数据关系正确的是 (填字母)。
A.α1+α2=1 B.Q1+Q2=Q C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0 mol F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体积压缩到1 L,若在第8min达到新的平衡时A2的总转化率为75%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
⑷熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出该碳酸盐燃料电池(MCFC)正极的电极反应式____________________________。
已知A、B、C、D、E、F、G、H可以发生如下图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。
请填空:
(1)写出E的两种用途、。
(2)反应②的离子方程式为。
(3)反应③的化学方程式是。
(4)反应④的离子方程式是。
(5)写出一个由A生成H的置换反应方程式:。
如何除去下列各粉末状混合物中的杂质(括号内为杂质),请选用下面提供的试剂和操作,将标号填在表内。
供选试剂:A盐酸;B烧碱溶液;C氧气;D水;ECO2;F不用其他试剂
供选操作:①加热;②加热熔融;③过滤;④结晶
| 含杂质的物质 |
所加试剂 |
主要操作 |
| (1)SiO2(NaHCO3) |
||
| (2)SiO2(CaCO3) |
||
| (3)SiO2(Si) |
||
| (4)NaCl(SiO2) |
下图是关于药物华素片(西地碘片)的使用说明书,以下为说明书的部分内容:
| 华素片(西地碘片)使用说明书 【品名或组成】 品名:西地碘片 组成:华素片 英文名:Cydiodine Tablets 华素片(西地碘片)的主要活性成分是分子碘,含量1.5 mg/片。将碘利用分子分散技术制成分子态西地碘,并含适量薄荷脑等 【贮藏】 遮光、密闭、阴凉处保存 【有效期】 二年 |
(1)根据上述说明和所学知识回答:
①华素片中含有的活性成分是(写分子式)。
②请推断华素片(填“是”或“不是”)白色。
(2)某学生为验证华素片中确实含有上述成分,设计实验如下。请填空:
①取一粒药片放入研钵中研碎,再将药粉装入试管并加入约2 mL蒸馏水;向试管中再加入约2 mL(填选项字母),并用力振荡。
A.酒精(密度比水小,与水以任意比混溶)
B.四氯化碳(密度比水大,不溶于水)
②描述加入该液体后可能观察到的现象。
③选用该液体的原因是。
(3)请再设计另一种方法,验证华素片中的成分(请叙述实验原理、操作方法和实验结论)。
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
(1)步骤③的离子方程式:。
(2)步骤⑤中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是。
(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过(填试剂名称)溶液,以除去氯气。
(4)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因:。
(5)步骤①中用硫酸酸化可提高Cl2的利用率,理由是。
(6)提取溴单质,采用蒸馏“溴水混合物Ⅱ”而不是蒸馏“溴水混合物Ⅰ”,请说明原因:。
海水的综合利用可以制备金属镁,其流程如图所示: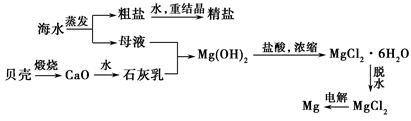
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式:。
用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是。
(2)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤:。
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的。
溶解时:;
过滤时:;
蒸发时:。