氢能被视为未来的理想清洁能源,科学家预测“氢能”将是21世纪最理想的新能源。目前分解水制氢气的工业制法之一是“硫—碘循环”,主要涉及下列反应:
Ⅰ SO2+2H2O+I2= H2SO4+2HI Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4= 2SO2↑+O2↑+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行 b.反应I中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1molH2
(2)一定温度下,向2L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0—2min内的平均反应速率v(HI)= 。该温度下,反应2HI(g) H2(g)+I2(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
H2(g)+I2(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)SO2在一定条件下可被氧化生成SO3,其反应为:2SO2 (g) + O2(g)  2SO3(g) △H<0。某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
2SO3(g) △H<0。某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。 
①a电极的电极反应式为 ;
②若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为 。
(4)实际生产还可以用氨水吸收SO2生成亚硫酸的铵盐。现取a克该铵盐,若将其中的SO2全部反应出来,应加入10 mol/L的硫酸溶液的体积范围为 。
下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。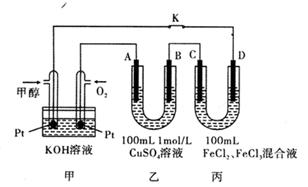
(1)甲中负极的电极反应式为____。
(2)乙中A极析出的气体在标准状况下的体积为____。
(3)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系右图,则图中②线表示的是离子的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要mL 5.0 mol/L NaOH溶液。
(1)将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
H2NCOONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡气体总浓度(×10—3 mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①氨基甲酸铵分解反应的焓变△H 0(填“>”、“<”或“=”)。
②可以判断该分解反应已经达到化学平衡的是____。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25.0℃时的分解平衡常数为。
(2)25℃时,NH3.H2O电离常数Kb=1.8×10—5,Mg(OH)2的溶度积常数Ksp=1.8×10—11,用pH计测得0.5 mol/L氨水溶液的pH约为。在某氯化镁溶液中加入一定量的某浓度的烧碱后,测得混合液pH =11.0,则此温度下残留在溶液中的c(Mg2+)=____。(已知lg2≈0.3、lg3≈0.5)。
某研究性学习小组利用下列原料和流程制备CuSO4·5H2O。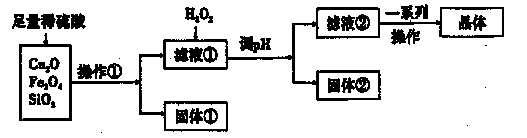
已知:Cu+在酸性条件下不稳定,易生成金属Cu和Cu2+。
(1)操作①的名称为____。,
(2)若固体①的成分为混合物,则其成分的化学式为____。
(3)将H2O2加入滤液①中,发生反应的离子方程式为。
(4)调pH可选用的药品为____。
| A.NaOH溶液 | B.CuO | C.氨水 | D.CuCO3 |
(5)获得的CuSO4·5H2O晶体表面附着杂质离子,常用酒精洗涤的原因是。
如图为部分短周期元素化合价与原子序数的关系图。请回答下列问题。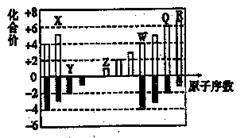
(1)元素Q位于周期表中第周期______族。
(2)将X、Z、Q、R四种元素的氢化物各1mol和水混合后,分剜得到l L溶液,所得水溶液碱性最强的氢化物的电子式是。
(3)Z的最高价氧化物对应的水化物与W的单质反应的化学方程式为。
(4)水中锰含量超标,容易使洁具和衣物染色、使水产生异味。RY2可以用来除去水中超标的Mn2+,生成一种黑色沉淀,同时测得消耗13.50 g RY2时,共转移了1 mol电子。则反应的离子方程式是____。
阿明洛芬属于苯丙酸类抗炎药,镇痛效果优于布洛芬。下图是阿明洛芬的一条合成路线。
(1)反应①为取代反应,该步反应物Me2SO4中的“Me”表示,D中官能团的名称是。
(2)写出E的结构简式:。
(3)G能发生的反应类型是(填字母序号)
| A.取代反应 | B.酯化反应 | C.加聚反应 | D.还原反应 E.加成反应 |
(4)写出F在NaOH溶液中反应的化学方程式:。
(5)写出所有满足下列条件的B的同分异构体:。
①只含有一个环(既苯环)的芳香族化合物;②核磁共振氢谱中氢峰的个数相比B的其它同分异构体最少。