一定条件下存在反应:C(s)+H2O(g) CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。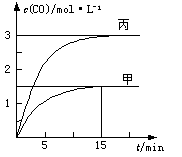
| 容器 |
甲 |
乙 |
丙 |
| 容积 |
0.5 L |
0.5 L |
V |
| 温度 |
T1 ℃ |
T2 ℃ |
T1 ℃ |
| 起始量 |
2 molC 1 molH2O |
1 molCO 1 molH2 |
4 molC 2 molH2O |
下列说法正确的是
A.甲容器中,反应在前15 min的平均速率v(H2)="0.1" mol·L-1·min-1
B.丙容器的体积V<0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)="0.4" mol,则T1< T2
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
| W |
X |
|
| Y |
Z |
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性强于Y
D.Z元素单质在化学反应中只表现氧化性
海带中碘元素的分离实验中,在灼烧后的海带灰中加入蒸馏水,煮沸2~3 min,再过滤,得到滤液。煮沸的目的是
| A.加快碘元素与水反应的速率 | B.使溶液浓缩 |
| C.使空气中的氧气更多地进入溶液 | D.加速碘化物的溶解 |
下图中每条折线表示周期表ⅥA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
| A.H2S | B.HCl | C.PH3 | D.SiH4 |
下列有关物质性质的比较,正确的是
| A.热稳定性:HF<HCl<HBr | B.微粒半径: O2->Mg2+>Cl- |
| C.第一电离能:Si>Al>Mg | D.电负性:Si>Al>Mg |
下列有关试剂的保存方法错误的是
| A.浓硝酸保存在棕色玻璃试剂瓶中 |
| B.少量的金属锂保存在煤油中 |
| C.氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 |
| D.少量液溴通常保存在棕色玻璃试剂瓶中,并在液溴上加少量水液封 |