(14 分) 一氧化碳被广泛应用于冶金工业和电子工业。
⑴高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) △H="a" kJ·mol-1
CO(g)+3Fe2O3(s)=CO2(g)+2Fe3O4(s) △H="b" kJ·mol-1
反应3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)的△H= kJ·mol-1(用含a、b 的代数式表示)。
⑵电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g) +CO(g) △H>0
CH3OH(g) +CO(g) △H>0
①第一步反应的机理可以用下图表示:
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。
⑶为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X—射线衍射谱图如图所示(X—射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为 。
⑷某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2 g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4(沸点43 ℃),并在180 ℃时使Ni(CO)4重新分解产生镍单质。
上述两步中消耗CO的物质的量之比为 。
⑸为安全起见,工业生产中需对空气中的CO进行监测。
①粉红色的PdCl2溶液可以检验空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀。每生成5.3gPd沉淀,反应转移电子数为 。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图所示。这种传感器利用原电池原理,则该电池的负极反应式为 。
[2012·濮阳一模]A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
(1)X的单质与A反应的化学方程式是。
(2)若试剂1是NaOH溶液。X的单质与试剂1反应的离子方程式是
。
(3)若试剂1和试剂2均是稀硫酸。
①将物质C溶于水,其溶液呈性(填“酸”、“碱”或“中”)。
②某高效净水剂是由Y(OH)SO4聚合得到的,工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式为
。
[2012·课标全国卷] 铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物为FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:________________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为__________________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
______________________________;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________________________,该电池总反应的离子方程式为_____________________________________。
[2012·临沂一模]下列转化关系所涉及的物质都是中学化学常见物质。已知A、B为氧化物,C为固体单质,D为黄绿色气体。
请回答:
(1)指出A中存在的化学键类型:。
(2)写出M与过量氨水反应的离子方程式:。
(3)向溶液N中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是
_____________________。
(4)电解熔融氧化物A,阳极的电极反应方程式为。
(5)B与浓酸X反应的化学方程式为。
(6)能不能直接蒸发溶液M得到M晶体?(填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作?。
[2012·西安交大附中一模]A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol·L-1A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
请回答下列问题:
(1)根据以上事实推断A—E的化学式:
A;B;C;D;E。
(2)请用离子方程式表示A溶液显碱性的原因。
(3)写出③、④的离子方程式:③;④。
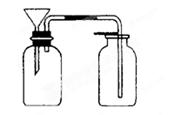
某化学小组的同学到实验室学习。在实验桌上摆有下列仪器:
(1)甲同学想用d进行实验,请你说出该仪器(已经洗涤干净)使用时的第一步操作:__________________________________。
(2)关于e的用途,乙同学说可组成防倒吸装置。你还能说出其他两种用途吗?
①_____________________________;②____________________________。
(3)丙同学想用下图装置用大理石和稀盐酸反应制取CO2。教师指出,这需要太多的稀盐酸,造成浪费。该同学选用了上面的一种仪器,加在装置上,解决了这个问题。请你把该仪器画在图中合适的位置。