向甲、乙两个容积均为1 L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2 mol SO2、1 mol O2,乙充入1 mol SO2、0.5 mol O2),发生反应:2SO2(g)+O2(g) 2SO3(g);ΔH=-197.74 kJ·mol-1。
2SO3(g);ΔH=-197.74 kJ·mol-1。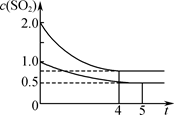
一段时间后达到平衡,测得两容器中c(SO2)(mol·L-1)随时间t(min)的变化关系如右图所示。下列说法正确的是( )
| A.热量:Q(甲)<2Q(乙) |
| B.压强:p(甲)<2p(乙) |
| C.乙中前5 min内的反应速率v(O2)=0.10 mol·L-1·min-1 |
| D.保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2 mol O2、0.4 mol SO3,则此时v(正)<v(逆) |
下列推断正确的是
| A.SiO2是酸性氧化物,能与NaOH溶液反应 |
B.Na 2O、Na2O2组成元素相同,与 CO2反应产物也相同 2O、Na2O2组成元素相同,与 CO2反应产物也相同 |
| C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在 |
| D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
下列事实能用同一原理解释的是
| A.SO2、Cl2均能使品红溶液褪色 |
| B.NH4HCO3晶体、固体I2受热均能变成气体 |
| C.S与Fe、Cu反应均生成低价硫化物 |
| D.ClO-与S2-或H+均不能共存 |
下列实验中,金属或固体可以完全溶解的是
| A.在H2O2溶液中加入少量MnO2粉末 |
| B.镀锌铁皮加入足量的NaOH溶液中 |
| C.1 mol铜片与含2 mol H2SO4的浓硫酸共热 |
| D.常温下1 mol铜片投入含4 mol HNO3的浓硝酸中 |
将磁性氧化铁放入稀HNO3中可发生如下反应: 3Fe3O4+28HNO3 ="==" 9Fe(NO3)x+ NO↑+14H2O,下列判断合理的是
3Fe3O4+28HNO3 ="==" 9Fe(NO3)x+ NO↑+14H2O,下列判断合理的是
| A.Fe(NO3)x中的x为2 |
| B.反应中每还原0.2mol氧化剂,就有0.6mol电子转移 |
| C.稀HNO3在反应中只表现氧化性 |
| D.磁性氧化铁的所有铁元素全部被氧化 |
氧化还原反应中,水的作 用可以是氧化剂、还原剂、既是氧化剂又是还
用可以是氧化剂、还原剂、既是氧化剂又是还 原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
| A.2Na2O2+2H2O=4NaOH+O2↑ |
| B.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| C.4NO2+O2+2H2O=4HNO3 |
| D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |