下列离子方程式正确的是
| A.1mol Cl2通入含有2mol FeI2的溶液中:2Fe2++2I﹣+2Cl2=2Fe3++4Cl﹣+I2 |
| B.澄清石灰水与少量小苏打溶液混合:Ca2++OH﹣+HCO3﹣=CaCO3↓+H2O |
| C.AlCl3溶液中加入过量氨水:Al3++4OH﹣=AlO2﹣+2H2O |
| D.向银氨溶液中加入足量的盐酸:[Ag(NH3)2]++OH﹣+3H+=Ag++2NH4++H2O |
下列三种有机物是某些药物中的有效成分: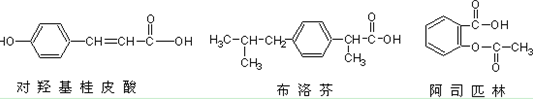
以下说法正确的是()
| A.三种有机物都能与浓溴水发生反应 |
| B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 |
| C.将等物质的量的三种物质加入氢氧化钠溶液中,阿司匹林消耗氢氧化钠最多 |
| D.使用FeCl3溶液和稀硫酸不能鉴别出这三种有机物 |
2011年是国际化学年,我国的主题是“化学——我们的生活,我们的未来”。下列有关叙述不正确的是( )
| A.利用可降解的“玉米塑料”生产一次性饭盒,可防止白色污染 |
| B.利用太阳能、潮汐能、风力发电,以获取清洁能源 |
| C.采用纳米二氧化钛光触媒技术将汽车尾气中的NO和CO转化为无害气体 |
| D.常在包装袋内放入生石灰防止月饼等富脂食品氧化变质 |
右图表示4-溴环己烯所发生的4个不同反应。其中,产物官能团种类不会减少的反应是( )
| A.②③ | B.③④ |
| C.①② | D.①④ |
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g) + 2B(g) xC(g)ΔH=-192kJ·mol-1。向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
xC(g)ΔH=-192kJ·mol-1。向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是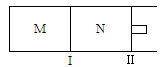
| A.若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N) |
| B.若x>3,达到平衡后B的转化率关系为:α(M)>α(N) |
| C.若x<3,C的平衡浓度关系为:c(M)>c(N) |
| D.x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等 |
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)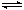 CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是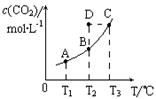
A.反应CO(g)+H2O(g)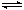 CO2(g)+H2(g)的△H >0 CO2(g)+H2(g)的△H >0 |
| B.在T2时,若反应进行到状态D,则一定有v(正)<v(逆) |
| C.欲使D状态变为C状态,可以采取快速升温至T3的方式 |
| D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |