X、Y、Z、W为短周期元素,原子半径X>Y>Z>W,X、Y、Z处于同一周期,Z、W处于同一主族,X、Y、Z原子序数之和为40,X是短周期中除稀有气体元素外半径最大的元素。下列说法正确的是
| A.若X、Y、W形成的化合物为XYW2,则其水溶液可以显碱性 |
| B.Y的最高价氧化物对应的水化物一定是碱 |
| C.稳定性:W的氢化物>Z的氢化物,沸点:Z的氢化物>W的氢化物 |
| D.X、Y的氧化物晶体类型一定相同 |
下列说法正确的是
| A.最外层电子排布为ns2的元素一定处于周期表IIA族 |
B.主族元素X、Y能形成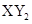 型化合物,则X与Y 的原子序数之差可能为2或5 型化合物,则X与Y 的原子序数之差可能为2或5 |
| C.亚硫酸的酸性比硫酸强 |
| D.金属元素的电负性一定比非金属元素的电负性大 |
下列说法正确的是
| A.元素周期表每一周期元素原子的最外层电子排布均是从ns1 过渡到ns2np6 |
| B.元素周期表中ⅢB到ⅡB的10个纵行的元素都是金属,统称过渡金属元素 |
| C.原子核外电子排布为1s1的原子与原子核外电子排布为1s22s1的原子的化学性质相似 |
| D.所有的非金属元素都分布在p区 |
短周期金属元素甲~戊在元素周期表中的相对位置如下表所示,下面判断正确的是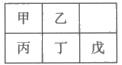
| A.原子半径:丙<丁<戊 |
| B.金属性:甲>丙 |
| C.氢氧化物碱性:丙>丁>戊 |
| D.最外层电子数:甲>乙 |
在乙烯分子中有5个σ键、1个π键,它们分别是
| A.碳原子sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 |
| B.碳原子sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 |
| C.C—H之间是sp2杂化轨道形成的σ键,C—C之间是未参加杂化的2p轨道形成的π键 |
| D.C—C之间是sp2杂化轨道形成的σ键,C—H之间是未参加杂化的2p轨道形成的π键 |
现有四种元素的基态原子的电子排布式如下:①ls22s22p63s23p4②ls22s22p63s23p3③ls22s22p3④ls22s22p5 , 则下列有关比较中正确的是
| A.第一电离能:④>③>②>① | B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① | D.最高正化合价:④>③=②>① |