X、Y、Z、W是元素周期表前四周期中的常见元素。其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的一种核素的质量数为14,中子数为8 |
| Y |
Y与X同周期,且它的一种氧化物只能用排水法收集 |
| Z |
Z的单质常温下为黄绿色气体 |
| W |
W的原子核外电子总数是其电子层数的4倍 |
下列说法正确的是
A.原子半径:W> X>Y,离子半径:W>Z
B.氧化物对应的水化物的酸性:Z> Y>X
C.Y的最高正价含氧酸,可由它的氢化物为原料来制取
D.W的单质与X的一种氧化物不能发生置换反应
下列物质有固定熔、沸点的是( )
| A.液化石油气 |
| B.汽油 |
| C.石蜡 |
| D.乙苯 |
水经过磺化煤处理之后,阳离子浓度最大的是( )
| A.Ca2+ |
| B.Mg2+ |
| C.Na+ |
| D.H+ |
从海水中提取镁可按如下步骤进行:①把贝壳(主要成分是碳酸钙)煅烧成石灰;②在引有海水的水渠中加入石灰,经过沉降,然后过滤得沉淀物;③将沉淀物与稀盐酸反应,然后结晶、过滤、干燥;④电解获得产物。根据上述提取镁的全过程,没有涉及到的反应类型是( )
| A.分解反应 |
| B.化合反应 |
| C.置换反应 |
| D.复分解反应 |
下列关于某些社会热点问题的说法中,不正确的是( )
| A.禁止使用含铅汽油是为了提高汽油的燃烧效率 |
| B.甲醇超标的酒不能饮用 |
| C.甲醛是某些劣质装饰板材释放的常见污染物之一 |
| D.臭氧在高空对人类有保护作用 |
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4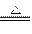 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法中不正确的是()
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法中不正确的是()
| A.CO2是氧化产物 |
| B.H2C2O4在反应中被氧化 |
| C.H2C2O4的氧化性强于ClO2的氧化性 |
| D.1mol KClO3参加反应,转移的电子为1mol |