设NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA |
| B.常温下,22gCO2和N2O混合气体中,含有的原子数目为1.5NA |
| C.标准状况下,2.24L甲醇中含有C—H键的数目为0.3NA |
| D.a mol·L—1的氯化铁溶液中,若Fe3+的数目为 NA,则Cl—的数目为3NA |
将右图所示实验装置的K闭合,下列判断正确的是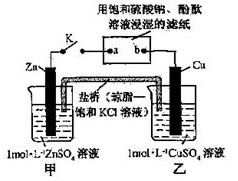
| A.Zn电极上发生还原反应 |
| B.片刻后盐桥中的Cl-向乙装置中移动 |
| C.片刻后在a点滴加酚酞观察到滤纸变红色 |
| D.片刻后在b点滴加淀粉碘化钾溶液观察到滤纸无变化 |
下列表达不正确的是
A.NaHS在水中的电离方程式为:NaHS=Na++HS- 和HS-  H++S2- H++S2- |
| B.同物质的量浓度的氨水和盐酸反应至中性时所用体积:V(NH3·H2O)<V(HCl) |
| C.Na2SO3溶液中:c(H+)+ c(HSO3-)+ 2c(H2SO3)= c(OH-) |
| D.同浓度的下列溶液中,c(CH3COO-)的大小:CH3COONa>CH3COONH4>CH3COOH |
8.34gFeS04·7H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示
| A.温度为78℃时固体物质M的化学式为FeSO4•5H2O |
| B.温度为l59℃时固体物质N的化学式为FeSO4•3H2O |
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4 FeO+SO3↑ FeO+SO3↑ |
| D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3 |
下列说法正确的是
| A.铝热反应是炼铁最常用的方法 |
| B.高纯度的硅单质用于制作光导纤维 |
| C.二氧化氯具有强化性,可用于自来水的杀菌消毒 |
| D.二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.1.0mol·L-1的KNO3溶液:Cl-、SO42-、H+、Fe2+ |
| B.c(H+)=1.0×10-12mol·L-1的溶液:K+、Na+、CH3COO-、Br- |
| C.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、 |