在一个容积为2 L的恒容密闭容器中加入0.2 mol CO和0.4 mol H2,发生反应:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
实验测得在300℃和500℃时,甲醇的物质的量(mol)随时间的变化如下表所示。
| |
10 min |
20 min |
30 min |
40 min |
50 min |
60 min |
| 300℃ |
0.080 |
0.120 |
0.150 |
0.168 |
0.180 |
0.180 |
| 500℃ |
0.120 |
0.150 |
0.156 |
0.160 |
0.160 |
0.160 |
下列说法正确的是
A.该反应的ΔH>0,升高温度,化学平衡常数K增大
B.300℃时,前20 min内的反应速率v(H2)="0.003" mol·L-1·min-1
C.采取加压、增大c(H2)、加入合适的催化剂等措施都能提高CO的转化率
D.500℃时,在起始时向容器中加入0.1 mol CO和0.3 mol H2,可计算出反应达平衡后甲醇的浓度
下列对实验现象的解释与结论正确的是
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法不正确的是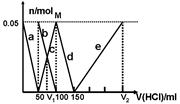
| A.M点时生成的CO2为0mol |
| B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| C.V1:V2=1:4 |
| D.a曲线表示的离子方程式为:AlO2-+H+ + H2O=Al(OH)3↓ |
青石棉是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2。青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是
| A.青石棉是一种硅酸盐材料 |
| B.青石棉中含有一定量的石英晶体 |
| C.青石棉的化学组成可表示为Na2O·3FeO·Fe2O3·8SiO2·H2O |
| D.1 mol青石棉能将含1 mol HNO3的稀硝酸还原 |
取一定质量的均匀固体混合物Cu、Cu2O和 CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为
| A.3.6mol/L | B.3.2mol/L | C.2.8mol/L | D.2.4mol/L |
已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高.则下列溶液沸点最高的是
| A.0.01 mol/L的蔗糖溶液 |
| B.0.01 mol/L的CaCl2溶液 |
| C.0.02 mol/L的NaCl溶液 |
| D.0.02 mol/L的CH3COOH溶液 |