实验室制取气体时所需的一些装置如图所示,请回答下列问题: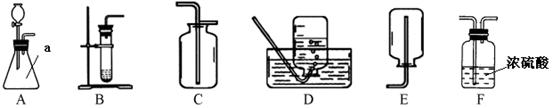
(1)写出装置图中仪器名称:a________。
(2)C实验室里用过氧化氢溶液和二氧化锰混合制取氧气的化学方程为 ;要制备干燥的氧气,所选择装置的连接顺序为 (填字母)。选择气体收集方法时,气体的下列性质:①颜色 ②密度 ③溶解性 ④可燃性,必须考虑的是 (填序号)。
(3)MnO2在该反应中可以重复使用,理由是 。
生活中化学知识随处可见。
(1)医疗急救常用到纯氧,其原因是_________________________________________________。
(2)将泡腾片(主要成分是碳酸氢钠、柠檬酸等)放入水中,观察到有大量气泡产生,其原因是
____________________________________________________________________________。
(3)铝制品表面会形成一层致密的氧化膜,该氧化膜的成分是____________。
实验室要配制50g 10%的氯化钠溶液,其操作示意图如下图所示。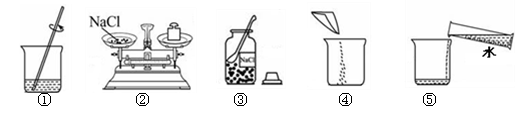
(1)①中玻璃棒的作用是。
(2)该实验的正确操作顺序为(填数字序号)。
根据下列装置回答问题。
(1)甲图中集气瓶底部放少量水的目的_______。
(2)乙图中观察到_______,说明二氧化碳具有不能燃烧、_______的性质。
根据下图回答问题。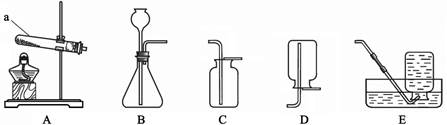
(1)仪器a 的名称是_______。
(2)实验室用高锰酸钾制取氧气的化学方程式为 ________,选用的发生装置是________(填字母序号,下同),收集装置是______或E。
(3)实验室制取二氧化碳时,选用的发生装置是__________ 。
阅读下面科普短文。1807年,科学家首次利用电解氢氧化钠的方法制备金属钠,同时得到氧气和水。1921年,科学家通过电解熔融氯化钠的方法制备金属钠同样获得成功。金属钠用小刀切开外皮后,可以看到银白色的金属光泽,钠的密度是0.97g/cm3。钠跟氧气在常温下就能发生反应。将一小块绿豆粒大小的钠,放入滴加过几滴酚酞试液的水中,可观察到钠浮在水面上,熔成闪亮的小球,在水面上来回游动,发出“嘶嘶”的响声,溶液会变红。收集反应后产生的气体,经检验发现其具有可燃性。
金属钠可用于制造一种抗爆剂——四乙基铅((C2H5)4Pb),它能降低汽油的爆震性,减少发动机产生的噪音。四乙基铅通常是使氯乙烷(C2H5Cl)跟金属钠和铅的合金一起反应而制成的。
依据文章内容,回答下列问题。
(1)钠的物理性质(答出一点即可)。
(2)钠的用途。
(3)钠与水反应的化学方程式为。
(4)电解氢氧化钠和电解熔融氯化钠的原理相同,他们都属于基本反应类型中的______反应。
(5)实验室中的金属钠通常保存在煤油中的原因是________。(填字母序号)
| A.钠是金属 |
| B.钠能与氧气反应 |
| C.钠能与水反应 |
| D.钠的密度比煤油的密度(0.8g/cm3)大 |