常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如下图,下列判断错误的是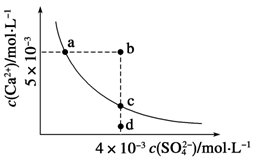
| A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 |
| B.a点对应的Ksp不等于c点对应的Ksp |
C.b点将有沉淀生成,平衡后溶液中c(SO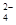 )一定等于3×10-3 mol·L-1 )一定等于3×10-3 mol·L-1 |
| D.向d点溶液中加入适量CaCl2固体可以变到c点 |
下列离子方程式书写正确的是
| A.等物质的量的 CO2与氢氧化钠溶液反应:CO2+2OH-=CO32-+H2O |
| B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| C.氢氧化钙溶液与等物质的量的稀H2SO4混合:Ca2++OH-+H++SO42- =CaSO4↓+H2O |
D.用石墨电极电解饱和食盐水:2H2O+2Cl- Cl2↑+H2↑+ 2OH- Cl2↑+H2↑+ 2OH- |
A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是
A.若X为Cl2,则C可能为FeCl3
B.若X为KOH溶液,则A可能为AlCl3
C.若X为O2,则A一定为硫化氢
D.若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2=Cu2S+2FeS+SO2,下列说法不正确的是
| A.SO2既是氧化产物又是还原产物 |
| B.CuFeS2既作还原剂也作氧化剂,硫元素被氧化 |
| C.每生成1 molCu2S,有4mol硫被氧化 |
| D.每转移1.2 mol电子,有0.2 mol硫被氧化 |
下列说法正确的是
| A.Na、Fe分别与不足量的稀硫酸反应所得溶液均呈中性 |
| B.将Ba(OH)2溶液滴到明矾溶液中,当SO42-刚沉淀完时,铝以Al(OH)3的形式存在 |
| C.氢氧燃料电池以铂作电极,KOH溶液作电解质溶液,电池工作时溶液中的阴离子移向正极 |
| D.能通过化合反应制得FeCl2和Fe(OH)3 |
下列有关实验操作中,正确的是
| A.用试管取出试剂瓶中的NaOH溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
| B.银镜反应实验后的废液可先倒入水槽中,再用水冲入下水道 |
| C.向试管中滴加液体时,胶头滴管必须紧贴试管内壁,避免液体溅出 |
| D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |