乙烯是石油化工最重要的基础原料,请根据以下框图回答:
41.以石油为原料的系列化工生产过程中,得到大量乙烯的主要方法是_______(选填序号)。
a. 水解 b. 分馏 c. 裂解 d. 裂化
42.有机物A俗称______________,含有的官能团名称是_________________.
43.B的分子式为C2H4O2,与纯碱反应能生成二氧化碳气体,写出反应A+B→C的化学
方程式___________________________________________________________ (有机物用结构简式表示),该反应类型为______________________。
下表为元素周期表的一部分,请回答有关问题:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 4 |
⑨ |
⑩ |
(1)⑤和⑧的元素符号分别是__________和__________。
(2)表中最活泼的金属是__________,非金属性最强的元素是__________。(填写元素符号)
(3)表中能形成两性氢氧化物的元素是__________,分别写出该元素的氢氧化物与⑥和⑨最高价氧化物的水化物反应的化学方程式:______________________________, ________________________________。
(4)请设计一个实验,比较⑦⑩单质氧化性的强弱:
_________________________________________________________________。
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为: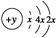 ,B最外层电子数是2,C的气态氢化物的水溶液呈碱性,据此填空:
,B最外层电子数是2,C的气态氢化物的水溶液呈碱性,据此填空:
(1)A的元素名称为________,其气态氢化物的稳定性比CH4________(填“强”或“弱”)。
(2)C、D的最高价氧化物的水化物的酸性大小为________>________(填化学式)。
(3)B的活泼性比钙的________(填“强”或“弱”)。
A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。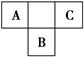
(1)写出A、B、C三元素名称______、______、______。
(2)C在元素周期表中的位置是_____________________________________。
(3)B的原子结构示意图为________,C的氢化物与B的氢化物的稳定性强弱顺序为________>________(填化学式)。
(4)比较A、C的原子半径:A________C,写出A的气态氢
化物与A的最高价氧化物对应水化物反应的化学方程式:___________________________。
(1)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是________。
(2)已知某粒子的结构示意图为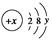
试回答:
①当x-y=10时,该粒子为________(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,粒子可能为(填名称)________、________、________、________、________。
③写出y=3与y=7的元素最高价氧化物对应水化物发生反应的离子方程式__________________________。
现有下列基本粒子:1H、2H、3H、1H+、234U、235U、238U、40K、40Ca、Cl2、14N、14C,请回答下列问题:
(1)其中,它们分属________种元素,属于氢元素的核素有________种,属于铀元素的核素有________种。互为同位素的原子分别为________,________。
(2)质量数相等的粒子为________,________(可不填满,也可补充)。