今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干 燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
| A.Cl-不可能存在 | B.100mL溶液中含0.01mol CO32- |
| C.K+一定存在 | D.Ba2+一定不存在,Mg2+可能存在 |
下列图示变化为吸热反应的是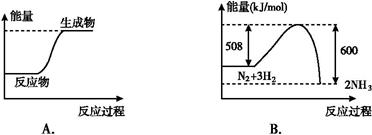

短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列比较正确的是
| A.元素的单质氧化性:Z> Y > X | B.最高正化合价:Z > Y |
| C.原子半径:Z < Y < X | D.气态氢化物的稳定性:Z < Y < X |
下列化学用语正确的是
| A.钙离子的化学式: Ca2+ | B.中子数为20的氯原子: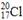 |
C.S2-的结构示意图: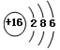 |
D.HCl的电子式: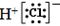 |
在右图所示的原电池中,下列说法不正确的是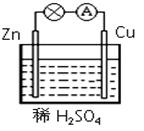
| A.溶液中的H+向Cu电极移动 |
| B.正极发生还原反应 |
| C.电子由锌片经电解质溶液流向铜片 |
D.负极反应为 Zn - 2e- Zn2+ Zn2+ |
在某一化学反应A + 2B 3C中,生成物B的浓度在10s内从1.5 mol/L变成2.0mol/L,则这10s内用生成物C的浓度变化表示的化学反应速率为
3C中,生成物B的浓度在10s内从1.5 mol/L变成2.0mol/L,则这10s内用生成物C的浓度变化表示的化学反应速率为
| A.0.05mol/(L·s) | B.0.05mol/L |
| C.0. 033 mol/(L·s) | D.0. 075 mol/(L·s) |