下列实验现象所对应的离子方程式不正确的是
| |
实 验 |
现 象 |
离子方程式 |
| A |
 |
在空气中放置一段时间后溶液呈蓝色 |
4H+ + 4I- + O2 ="=" 2I2 + 2H2O |
| B |
 |
开始时无气泡,后来有气泡 |
CO32-+H+=HCO3- HCO3-+H+ ="=" H2O+CO2↑ |
| C |
 |
溶液由黄绿色变为无色 |
Cl2 + 2OH- ="=" Cl- + ClO- + H2O |
| D |
 |
有白色沉淀生成,溶液由红色变为无色 |
Ba2++OH-+H++SO42-="=" BaSO4↓+H2O |
曾报道合成和分离了含高能量的正离子N5+的化合物N5AsF6。下列叙述错误的是()
| A.N5+共有34个核外电子 | B.N5+中氮原子间以共用电子对结合 |
| C.化合物N5AsF6中As化合价为+1 | D.化合物N5AsF6中F化合价为-1 |
2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现。使CO.NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。下列有关说法不正确的是()
| A.CO在铂表面被氧化生成CO2,铂起催化作用 |
| B.汽车尾气中NOx在铂表面发生反应的产物是N2 |
| C.CO在铂表面可能和O2.NOx反应 |
| D.NOx.CO.CO2均能与人体中的血红蛋白结合 |
某化学科研小组研究在其他条件不变,改变某一条件对A2(g)+3B2(g)
 2AB3(g)化学平衡状态的影响时,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据图示得出的结论正确的是( )
2AB3(g)化学平衡状态的影响时,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据图示得出的结论正确的是( )
| A.反应速率a>b>c |
| B.达到平衡时,A2的转化率大小为:b>a>c |
| C.若T2>T1,则正反应是吸热反应 |
| D.达到平衡时,AB3的物质的量大小为:c>b>a |
下列比较中,正确的是()
| A.常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大 |
| B.0.2mol/L NH4NO3和0.1 mol/L NaOH溶液等体积混合后: c(NH)>c(NO)>c(Na+)>c(OH-)>c(H+) |
| C.物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合: c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH) |
| D.同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3·H2O ④CH3COONH4,其中c(NH)由大到小的顺序是:①>②>④>③ |
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断不正确的是()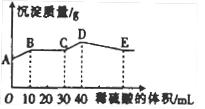
A.AB段发生反应的离子方程式为: |
| B.BC段发生反应的离子方程式为:H+ + OH-=H2O |
C.D点表示的沉淀的化学式为 、 、 |
| D.E点表示的溶液呈中性 |