某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0。如下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )
2Z(g);ΔH<0。如下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )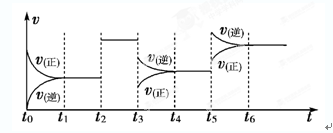
| A.在t4~t5时间内,X的转化率最低 | B.t3时降低了压强 |
| C.t5时升高了温度 | D.t2时加入了催化剂 |
一定量的浓硝酸与过量的铜充分反应,生成的气体是
| A.只有NO2 | B.只有NO | C.NO2和NO | D.NO2和H2 |
下图为铜—锌—稀硫酸原电池示意图,下列说法正确的是
| A.电子由铜片通过导线流向锌片 | B.锌得电子,被还原 |
| C.锌为负极,铜为正极 | D.该装置能将电能转变为化学能 |
下列描述的一定是金属元素的是
| A.易失去电子的物质 | B.原子核内有11个质子的元素 |
| C.原子的最外电子层只有1个电子的元素 | D.能与酸反应的物质 |
影响化学反应速率的因素很多,下列措施不能加快化学反应速率的是
| A.降低温度 | B.升高温度 | C.使用催化剂 | D.增加反应物浓度 |
下列各组离子,能在溶液中大量共存的是
| A.NH4+、SO42-、NO3- | B.Ba2+、SO42-、NO3- |
| C.Na+、H+、HCO3- | D.NH4+、OH-、Cl- |