下列实验设计及其对应的离子方程式均正确的是
| A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ |
| B.Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ |
| C.将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是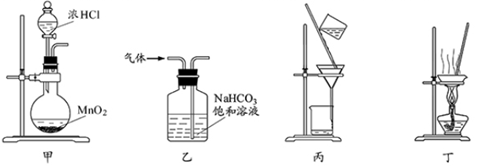
| A.用装置甲制取氯气 |
| B.用装置乙除去氯气中的少量氯化氢 |
| C.用装置丙分离二氧化锰和氯化锰溶液 |
| D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O |
下列叙述错误的是
| A.SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 |
| B.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 |
| C.用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 |
| D.用AgNO3溶液可以鉴别KC1和KI |
下列由相关实验现象所推出的结论正确的是
| A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |
| B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO2﹣4 |
| C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 |
| D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
NaCl是一种化工原料,可以制备一系列物质。下列说法正确的是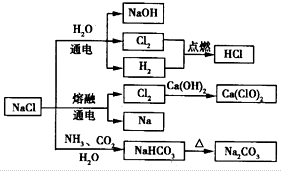
| A.25 ℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
| C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D.图4所示转化反应都是氧化还原反应 |
下图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是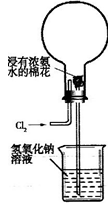
| A.烧瓶中立即出现白烟 |
| B.烧瓶中立即出现红棕色 |
| C.烧瓶中发生的反应表明常温下氨气有还原性 |
| D.烧杯中的溶液是为了吸收有害气体 |