向盛有氯气的集气瓶中,注入约五分之一的下列液体并轻轻振荡,观察到的现象记录如图所示,判断瓶中注入的液体是( )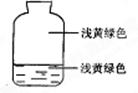
| A.AgNO3溶液 | B.NaOH溶液 |
| C.水 | D.石蕊溶液 |
22、用46g乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量的乙酸充分反应。下列有关叙述中不正确的是
| A.生成的水分子中含有18O | B.生成的乙酸乙酯中含有18O |
| C.可能生成88g乙酸乙酯 | D.不可能生成90g乙酸乙酯 |
21.关于基本营养物质的说法正确的是
A.所有蛋白质均可通过颜色反应来鉴别
B.葡萄糖和蔗糖不是同分异构体,但属于同系物
C.糖类、油脂、蛋白质都是由C、H、O三种元素组成的
D.油脂在酸性条件下水解为丙三醇和高级脂肪酸
20.海带中含有碘元素,某校研究性学习小组设计了如下实验步骤来提取碘:①通足量氯气②将海带烧成灰,向灰中加水搅拌③加CC14振荡④过滤⑤用分液漏斗分液。合理的操作顺序为
| A.①→③→⑤→②→④ | B.②→①→③→④→⑤ |
| C.②→④→①→③→⑤ | D.③→①→②→⑤→④ |
19.山梨酸是一种常见的食物添加剂,它是一种无色针状晶体或白色粉末,它的结构简式为CH3—CH=CH—CH=CH—COOH。下列关于山梨酸的叙述不正确的
| A.山梨酸易溶于乙醇 |
| B.山梨酸能与氢气发生加成反应 |
| C.山梨酸能和乙醇反应生成酯 |
| D.1mol山梨酸能和金属钠反应生成1mol氢气 |
18、下列各组物质之间能发生置换反应的是
| A.氯气通入碘化钠溶液中 | B.碘水中加入氯化钠溶液 |
| C.碘水加入溴化钠溶液中 | D.溴水加入氯化钠镕液中 |