设NA为阿伏加德罗常数,下列叙述错误的是( )
| A.18 gH2O中含有的质子数为10NA |
| B.标准状况下,22.4 L C2H5OH中含有的氢原子数为6 NA |
| C.46 g NO2和N2O4混合气体中含有原子总数为3NA |
| D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
目前世界上比较先进的电解制碱技术是离子交换膜法。右图所示为离子交换膜法电解原理示意图。下列有关说法错误的是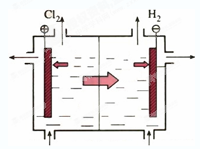
| A.位于电解槽中央的为阳离子交换膜 |
| B.电解槽的阳极由碳钢网制成,阴极用金属钛网 |
| C.电解槽的阴极产物是H2和NaOH溶液 |
| D.进入阳极室的是精制饱和食盐水 |
反应A+B―→C(ΔH<0)分两步进行:①A+B―→X(ΔH>0),②X―→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是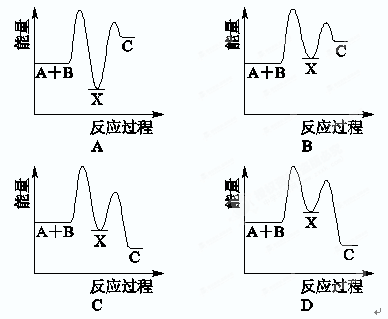
已知:2Zn(s) + O2(g)= 2ZnO(s) △H1=-701.0kJ·mol-1
2Hg(l)+ O2(g)= 2HgO(s) △H2=-181.6kJ·mol-1
则反应Zn(s) + HgO(s)= ZnO(s) + Hg(l)的△H为
| A.+519.4 kJ·mol-1 | B.+259.7 kJ·mol-1 |
| C.-259.7 kJ·mol-1 | D.-519.4 kJ·mol- |
一个电池的总反应为Zn+Cu2+=Zn2++Cu,下列电极判断正确且能实现该反应的原电池的正确组成是
| 正极 |
Zn |
Cu |
Cu |
Ag |
| 负极 |
Cu |
Zn |
Zn |
Cu |
| 电解质溶液 |
CuCl2 |
H2SO4 |
CuSO4 |
AgNO3 |
| A |
B |
C |
D |
下列热化学方程式中ΔH的绝对值能表示可燃物的燃烧热的是
| A.H2(g) + 1/2O2(g) = H2O (g) ΔH=-241.8 kJ/mol |
| B.CH4 (g) + 2O2(g) = CO2(g) +2H2O(g) ΔH=-802.3kJ/mol |
| C.2H2(g) + O2(g) = 2H2O(l) ΔH=-571.6 kJ/mol |
| D.CO(g) + 1/2O2(g) = CO2(g) ΔH=-283kJ/mol |