含氮废水中的NH4+在一定条件下可与O2发生以下反应:
① NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l) ΔH=-273 kJ·mol-1
② NO2-(aq)+1/2O2(g)=NO3-(aq) ΔH=-73 kJ·mol-1
下列叙述不正确的是
| A.升高温度,可使①②反应速率均加快 |
| B.室温下时0.1 mol·L-1 HNO2(aq) pH>1,则NaNO2溶液显碱性 |
| C.NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l)ΔH=-346 kJ·mol-1 |
| D.1 mol NH4+在①反应中与1 mol NO2-在②反应中失电子数之比为1:3 |
某温度下,可逆反应mA(g)+nB(g) pC(g)+qD(g)的平衡常数为K,下列不正确的是
pC(g)+qD(g)的平衡常数为K,下列不正确的是
| A.K越大,达到平衡时,反应进行的程度越大 |
B.K的表达式是K= |
| C.若Qc>K,则反应向逆反应方向进行 |
| D.正、逆反应的平衡常数数值相同,符号相反 |
下列叙述中,不正确的是
| A.某特定反应的平衡常数仅是温度的函数 |
| B.催化剂不能改变平衡常数的大小 |
| C.平衡常数发生变化,化学平衡必定发生移动达到新的平衡 |
| D.化学平衡发生移动,平衡常数必发生变化 |
对于可逆反应M+N Q达到平衡时,下列说法正确的是
Q达到平衡时,下列说法正确的是
| A.M、N、Q三种物质的浓度一定相等 |
B.M、N全部变成了Q |
| C.反应混合物中各组分的浓度不再变化 |
| D.反应已经停止 |
下列关于判断过程方向的说法正确的是
| A.所有自发进行的化学反应都是放热反应 |
| B.高温高压下可以使石墨转化为金刚石是自发的化学反应 |
| C.由焓判据和熵判据组合而成的复合判据,将更适合于所有的过程 |
| D.同一物质的固、液、气三种状态的熵值相同 |
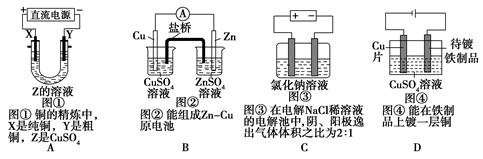
下列关于图像及描述说法都正确的是