化学课上老师为大家做了一个"燃纸成铁"的趣味实验,将一张滤纸(组成元素为
、
、
)用
浓溶液润湿,在酒精灯上烘干后点燃,滤纸变黑、红热,最终生成黑褐色物质.老师告诉大家:黑褐色物质中含有铁单质.聪明的小明对此进行了如下探究:
【提出问题】黑褐色物质中真的含有铁单质吗?
【探究过程】
Ⅰ.小明先从反应物元素组成分析,认为:因为
Ⅱ.
(1)为获得实验证据,小明做了实验1.
实验1:将黑褐色物质放入稀盐酸中,发现有连续微波气泡产生,若黑褐色物质中含有铁单质,则反应的化学方程式为
(2)小刚提出疑问是:由反应物的组成分析,能与稀盐酸反应产生气泡的物质不一定是铁单质,还可能是
小明查阅资料得知,在高温条件下不可能生成此类物质.
(3)为进一步证明黑褐色物质中有铁单质,小明又做了实验2.
实验2:将黑褐色物质放入
【得出结论】通过以上实验探究,证明黑褐色物质中确实含有铁单质.
张宁和刘明同学学习完酸、碱、盐后发现:碱溶液能使酚酞溶液变红,
溶液也能使酚酞溶液变红。通过学习知道,碱溶液使酚酞溶液变红,是因为碱在水中离解出
,那么
溶液中究竟是哪种粒子使酚酞溶液变红呢?请你帮助他俩完成实验探究。
【提出问题】
属于(填"酸"、"碱"、"盐"),为什么能使酚酞溶液变红?
【进行猜想】
(1)
使酚酞溶液变红。
(2)水分子使酚酞溶液变红。
(3)使酚酞溶液变红。
【设计实验】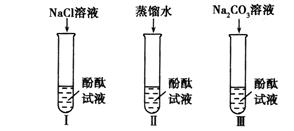
(1)实验Ⅰ的目的是为了验证猜想不成立。
(2)刘明同学认为实验Ⅱ没必要做,他的理由是。
(3)实验Ⅲ滴入
溶液,振荡,酚酞试液变红。向变红后的溶液中滴加
溶液至过量,振荡,出现的现象是,反应的化学方程式是。(提示:
溶液呈中性)
(4)由实验Ⅰ、Ⅱ、Ⅲ得出猜想(3)正确。张宁对此结论有些质疑,于是他查阅资料。
【查阅资料】
溶液中,
和
发生如下反应:
【得出结论】 溶液中使酚酞溶液变红的粒子是。
化学是以实验为基础的自然科学,下图所示为实验室常用的实验装置:
据此回答:
(1)实验室若用A装置制取氧气,写出反应的化学方程式。
(2)实验室通常用石灰石和稀盐酸反应制取
,所需要的装置组合是(填装置序号);也可以用碳酸氢钠(
)固体加热分解(产物为碳酸钠、二氧化碳和水)来制取,该反应的化学方程式为。
(3)F装置可用来测量生成的
气体的体积,其中在水面上放一层植物油的目的
是。
(4)实验室若检验
应选择装置,其反应的化学方程式为。
"鱼浮灵"主要成分是过碳酸钠(
),俗称固体双氧水。兴趣小组对其进行以下探究:
[性质探究]
(1)取少量"鱼浮灵"于试管中加水,有持续细小气泡缓慢放出;向试管中加入少量
粉末,产生大量气泡。将带火星木条伸入试管,木条,说明有
生成。
(2)取实验(1)中上层清液,测得溶液
;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清石灰水中,出现浑浊现象,说明有生成。
结论:过碳酸钠具有
和
的双重化学性质。
[工业制备]
(3)稳定剂的作用是;稳定剂中
和
发生复分解反应,生成一种难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为。
(4)浊液中加入异丙醇的作用是。
(5)操作Ⅱ中洗涤晶体的试剂最好选用(填字母)。
A.饱和
溶液 B水 C异丙醇 D稀盐酸
(6)根据下表数据,你认为上述制备反应的最佳温度范围是℃。
| 温度范围/℃ |
5~10 |
10~15 |
15~20 |
20~25 |
| 活性氧含量/% |
13.94 |
14.02 |
15.05 |
14.46 |
| "鱼浮灵"的产率/% |
85.49 |
85.78 |
88.38 |
83.01 |
注:活性氧含量是指产品中能转化为O2的氧元素的质量分数。
[组成测定]利用下图装置进行产品中活性氧含量测定和过碳酸钠(
)组成的测定(杂质对测定无影响)。
查阅资料:①"鱼浮灵"中活性氧含量≥13.0%是一等品,≥10.5%是合格品。
②过碳酸钠能与酸反应放出
和
。
(7)实验前先缓慢通
一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至
中样品完全反应;继续缓慢通,其目的是。
(8)若先滴入稀硫酸,后加热铜网,会导致
的值(填"偏大"或"偏小")。
(9)装置
的作用是(填序号)
①除去气体中的水蒸气 ②便于观察和控制气流速度
(10)实验测得C装置中铜网增重1.2
,
装置增重2.2
。该产品中活性氧含量为%;属于(填"一等品"或"合格品");
=。
兴趣小组同学向盛有生石灰的烧杯中加入碳酸钠溶液,搅拌、过滤、洗涤、干燥后得到固体A和溶液B,并对固体A和溶液B进行探究。
上述实验中发生的反应有:①
;②(写化学方程式)。
Ⅰ.固体A成分的探究及测定
[猜想]
①固体A中只有
;
②固体A中含有
和
;含有
的理由是。
[实验]
取少量固体A于试管中加足量水,振荡、静置,向上层清液中滴加硫酸铜溶液,出现,猜想②成立。
[组成测定]
取8.7g固体A于试管中,加足量稀盐酸至固体完全溶解,收集到纯净
2.2g,则固体A中
和
的质量比为。
Ⅱ.溶液B的成分探究
[猜想]
①溶液B中的溶质是
;
②溶液B中的溶质是
和
;
③溶液B中的溶质是
和
。
根据对固体A成分的探究,小组同学认为猜想③正确,其理由是。
[实验]
取少量溶液B于试管中,滴加溶液,产生白色沉淀,证明猜想③正确。
实验室使用块状石灰石(
)和稀盐酸制
,当观察不到有气泡产生,固体仍有剩余时,通常认为反应结束,剩余液呈中性。某兴趣小组对此进行了以下探究:
【实验操作】(1)向试管中加入5粒石灰石,倾倒约试管体积1/3的稀盐酸(1:1);观察不到气泡后,仍有固体剩余;将试管静置。
(2)取上层清液,用pH试纸测得溶液pH=2,说明溶液显性;
pH测定中,"上层清液滴到试纸上"的后一步操作是。
【实验思考Ⅰ】反应剩余液中有哪些物质?其中能使溶液pH=2的有哪些?
【实验探究Ⅰ】(1)甲同学通过实验排除了
的可能性。简述其实验方案。
(2)乙同学将
通入蒸馏水中至饱和,测得pH>5,。
(3)综合甲、乙两同学实验,得出的结论是:剩余液中还含有。
【实验思考Ⅱ】试管中剩余固体是否仍含有
?
【实验探究Ⅱ】小组同学向试管中继续加入稀盐酸(1:1),又有大量气泡产生。
(1)由此得出的结论是;写出反应的化学方程式。
(2)比较稀盐酸加入前后的实验现象,解释"又有大量气泡产生"的原因:。
【拓展延伸】(1)反应剩余液放置一段时间后,溶液pH增大,其主要原因是。
(2)假如用100g14.6%的稀盐酸和足量的石灰石反应,看不到气泡产生时,停止收集气体。收集到的
质量(选填">"、"<"、"=")8.8g。