硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的
、
、
M等,工艺流程

根据上图回答下列问题:
(1)将菱锌矿研磨成粉的目的是
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是
、
和
,相对分子质量是89,针铁矿中铁原子数︰氧原子数︰氢原子数=
(3)请写出氢氧化锌和稀硫酸反应的化学方程式
(4)"滤液3"之前加入锌粉的目的是
(5)"滤液3"之后的操作依次为
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于
近年来,多次发生煤矿瓦斯爆炸事件。瓦斯已成为导致我国煤矿特大恶性事故的“头号杀手”。
(1)当瓦斯爆炸时,下列自救措施不当的是(填序号)。
| A.站在原地不动 |
| B.背对爆炸地点迅速卧倒 |
| C.若眼前有水,应俯卧或侧卧于水中,并用湿毛巾捂住口鼻 |
| D.选择合适通道迅速逃生 |
(2)煤矿瓦斯爆炸有三个必须条件:瓦斯纯度达到爆炸极限、足够的和。对任何一个条件的有效控制都可避免瓦斯爆炸。你认为采取那些措施可以预防瓦斯爆炸事故?(任写二点)。这类事故的发生也提醒我们在做易爆气体的实验时应注意。
人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。下图是金属在实际生活中的应用。


电线金属丝炊具
(1)地壳中含量最高的金属元素是。
(2)根据上图推断,说出金属具有的两点物理性质有____________ 、____________。
(3)2008年奥运会主运动场“鸟巢”使用了大量的钢铁。钢铁与直接接触容易生锈造成损失,在钢铁表面涂油、刷漆等,都能防止钢铁生锈。
(4)用稀硫酸除去铁锈,其反应的化学方程式是。
某农场附近新建了一座燃煤火力发电厂后该农场的小麦产量急剧下降。经农场技术员测定:雨水pH约为4、土壤pH约为5。已知一些重要作物最适宜生长的土壤的pH如下表: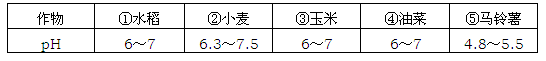
(1)据上表数据,你认为这种土壤最适合种植的作物是(填编号)_________。
(2)继续种小麦,你认为最好选用以下(填编号)________试剂来改良土壤。
①工业盐酸②熟石灰③纯碱
(3)该地区形成酸雨的主要原因是。
在我们的生活中,许多现象与化学有着密切的联系,从下列物质中选择恰当物质填空:小苏打、硫酸、熟石灰、活性炭、一氧化碳、甲醛、烧碱、氯化钠
生理盐水是医疗上常用的溶液,该溶液的溶质是_________;发酵粉可以使食品松软可口,属于发酵粉成分之一的是;农业技术人员对某些菜地的土壤进行分析,发现土壤呈酸性,不利于作物生长。你认为应当施用适量的___________来改良土壤结构;用于除去冰箱异味的是_________;用于制作动物标本的是________;用煤炉取暖时易发生中毒,主要是由于室内______排放不畅而引起的。
5月20日是“中国学生营养日”,请你用所学化学知识关注营养问题:
(1)妈妈每天为小东准备的食品有:奶类、豆类、鱼肉类、水果、蔬菜、面食等,这些食品中含有______________、_____________等人体所需营养素(只需填写两种即可),可以保证营养均衡。
(2)同学们喜爱喝的酸奶,其配料表部分为:①纯净水②鲜牛奶③白砂糖④柠檬酸⑤食用香精⑥维生素E等多种维生素。其中能为人体提供能量的是(填编号)。