下列两种物质的溶液混合后不能发生离子反应的是( )
| A.HNO3和Na2CO3 | B.NaCl和AgNO3 |
| C.K2SO4和BaCl2 | D.HNO3和BaCl2 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.使苯酚显紫色的溶液:NH4+、K+、SCN-、NO3- |
| B.澄清透明的溶液:Cu2+、Mg2+、SO42-、Cl- |
| C.0.1 mol·L-1 Na2CO3溶液:NH4+、Fe2+、SO42-、NO3- |
| D.c(Fe2+)=1.0 mol·L-1溶液:H+、K+、Cl-、MnO4- |
【原创】下列有关化学用语表述正确的是
A.S2-的结构示意图: |
B.CO2的比例模型: |
C.邻羟基苯甲酸的结构简式: |
| D.质子数为79、中子数为118的金(Au)原子:118 79Au |
化学与生产、生活、环境保护等密切相关。下列叙述正确的是
| A.绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 |
| B.新型材料聚酯纤维、光导纤维都属于有机高分子材料 |
| C.医药中常用酒精来消毒,是因为酒精能够使病毒的蛋白质发生变性 |
| D.CO2的水溶液呈酸性,CO2的大量排放会导致酸雨的形成 |
常温下,取pH=2的 HA溶液与HB溶液各1 mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示。下列叙述正确的是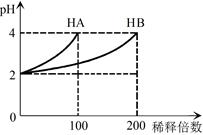
A.HB的电离方程式为HB=H++B-
B.稀释前,c(HB) > c(HA)=0.01 mol·L-1
C.NaA的水溶液中,离子浓度大小为c(Na+)>c(A-)>c(OH-)>c(H+)
D.NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)
【改编】W、X、Y、Z四种短周期元素。已知X原子的核外电子数和Ne原子相差1,在同周期中X原子半径最大,W、Y、Z在周期表中的相对位置如图,Z的非金属性在同周期元素中最强。下列说法正确的是
| A.原子半径大小比较:Z>Y>W>X |
| B.Z能够形成HZO3型化合物 |
| C.W与X形成的化合物只含有离子键 |
| D.W、X、Z只能形成一种化合物 |