下列离子方程式中正确的是( )
| A.向溶液Na2FeO4中加入稀H2SO4产生氧气:4FeO42-+2OH-=4Fe2++3O2↑+10H2O |
| B.向溶液NH4Al(SO4)2中滴入溶液Ba(OH)2恰好使(SO4)2-沉淀完全 2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O |
| C.向溶液Mg(HCO3)2中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O |
| D.向溶液Fe(NO3)2中加入稀氢碘酸:3 Fe2++4H+NO3-=3 Fe3++NO↑+2H2O |
互为同素异形体的是:
| A.白磷与红磷 | B.D2与H2 |
| C.正丁烷与异丁烷 | D. Cl与 Cl与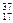 Cl Cl |
下列含氧酸中酸性最弱的是:
| A.H2SO4 | B.HClO4 |
| C.H2CO3 | D.HNO3 |
下列反应中,属于加成反应的是
| A.乙烯使酸性KMnO4溶液褪色 |
| B.将苯滴入溴水中,振荡后水层接近无色 |
| C.乙烯使溴水褪色 |
| D.甲烷与氯气混合,光照一段时间后黄绿色消失 |
下列属于直接利用太阳能的是
①光-热转换②光-电转换③光—化学能转换④光-生物质能转换
| A.①②③ | B.①③④ | C.①②④ | D.①②③④ |
2005年6月5日世界环境日主题是“营造绿色城市,呵护地球家园”。下列不符合这一主题的是
| A.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 |
| B.大量开采地下水,以满足社会对水的需求 |
| C.减少使用对大气臭氧层起破坏作用的氟氯代烷 |
| D.节约能源,提高能源利用率 |