W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W 的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
| W |
X |
|
| |
Y |
Z |
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性强于Y
D.Z元素单质在化学反应中只表现氧化性
下列有关物质的性质或应用的说法正确的是
| A.石油裂化可获得乙烯、丙烯和丁二烯 |
| B.食醋的主要成分是醋酸,将一定量的醋酸溶液稀释,溶液中各离子的浓度都减小 |
| C.盐析可提纯蛋白质并保持其生理活性 |
| D.油脂、蛋白质及所有糖类物质都可以在一定条件下发生水解反应 |
反应I和反应II都是有机合成中的重要反应:
下列有关说法正确的是
| A.反应I为还原反应,反应II为加成反应 |
| B.苯乙酮和2-环己烯酮分子中所有的碳原子一定处于同一平面上 |
| C.乙苯和2-环己烯酮均能使溴的四氯化碳溶液褪色且褪色原理相同 |
| D.分子中有苯环且能发生银镜反应的苯乙酮的同分异构体有3种 |
双酚A作为食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大。下列有关双酚A的叙述不正确的是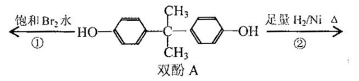
| A.双酚A的分子式是C15H16O2 |
| B.双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 |
| C.反应①中,1mol双酚A最多消耗2 mol Br2 |
| D.反应②的产物中只有一种官能团 |
木糖醇是一种新型的甜味剂,近年来正悄悄的走进人们的生活。木糖醇是一种理想的蔗糖代替品,它具有甜味适中、溶解性好、防龋齿、适合糖尿病患者等优点。木糖醇是一种白色粉末状的固体,结构简式为:CH2OH(CHOH)3CH2OH,下列有关木糖醇的叙述正确的是
| A.木糖醇与核糖(C5H10O5)互为同分异构体 |
| B.木糖醇与葡萄糖一样是一种单糖 |
| C.木糖醇可以与乙酸发生酯化反应 |
| D.木糖醇与甘油(CH2OHCHOHCH2OH)互为同系物 |
肾上激素是化学信使,随着血液走到身体各处,促使细胞发生变化。它的结构简式如下图。下列有关肾上激素的说法正确的是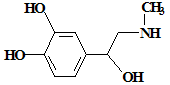
| A.分子式为C9H12NO3 |
| B.该分子中至少有9个原子共平面 |
| C.可以发生加成、氧化、消去、加聚反应 |
| D.可以和NaOH溶液、Na2CO3溶液反应,也可以和盐酸反应 |