某恒温密闭容器中,可逆反应A(s)  B+C(g) △H=" +" QkL/mol(Q>0)达到平衡。缩小容器体积,重新达到平衡,C的浓度比原平衡的浓度大。以下分析正确的是
B+C(g) △H=" +" QkL/mol(Q>0)达到平衡。缩小容器体积,重新达到平衡,C的浓度比原平衡的浓度大。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡不可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量QkJ
下列说法中正确的是()
| A.元素的化学性质取决于原子的核外电子层数 |
| B.原子的质量数主要是由原子的质子数和中子数决定 |
| C.质量数不同的原子互称同位素 |
| D.质量数等于元素的相对原子质量 |
元素的性质随着原子序数的递增呈周期性变化的本质原因是()
| A.元素的原子半径呈周期性变化 |
| B.元素的原子核外电子排布呈周期性变化 |
| C.元素的原子电子层数呈周期性变化 |
| D.元素的常见化合价呈周期性变化 |
天然气的主要成分是甲烷,其分子式为CH4,下列四位同学在讨论分子式CH4的意义,其中错误的是()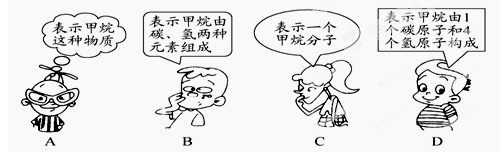
金属钛对人体体液无毒且能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关48Ti和50Ti的说法正确的是()
| A.48Ti和50Ti的质子数相同,互称同位素 |
| B.48Ti和50Ti的质量数不同,属于两种元素 |
| C.48Ti和50Ti的质子数相同,是同一种核素 |
| D.48Ti和50Ti的质子数相同,中子数不同,互称同素异形体 |
锌电池可望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应是2Zn+O2=2ZnO。下列有关它的说法正确的是()
| A.锌为电池负极,发生氧化反应 |
| B.电解质溶液是酸性溶液 |
| C.电池工作时,氧气与锌直接化合,生成氧化锌 |
| D.负极发生的反应是:Zn-2e-+H2O=ZnO+2H+ |