短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是
| A.W、Y、Z的非金属性大小顺序一定是Z>Y>W |
| B.W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z |
| C.Y、Z形成的分子空间构型可能是正四面体 |
| D.XZ3中含有离子键 |
在恒温恒容条件下,能使A(g)+B(g) C(g)+D(g)正反应速率增大的措施是()
C(g)+D(g)正反应速率增大的措施是()
| A.减小C或D的浓度 | B.增大D的浓度 |
| C.减小B的浓度 | D.增大A或B的浓度 |
下列有关原子结构和元素周期律表述正确的是()
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族
| A.①② | B.①③ | C.②④ | D.③④ |
下列叙述中正确的是()
| A.H和D原子中的质子数和中子数都不相等 |
| B.金刚石和石墨的性质完全相同 |
| C.O2和O3互为同位素 |
| D.某物质中只含一种元素,该物质不一定是纯净物 |
已知某元素的阳离子R2+的核内中子数为n,质量数为A,则mg它的氧化物中所含电子的物质的量是()
A.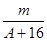 (A-n+8)mol (A-n+8)mol |
B.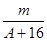 (A-n+10)mol (A-n+10)mol |
| C.(A-n+2)mol | D.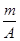 (A-n+6)mol (A-n+6)mol |
同一周期X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性是HXO4>H2YO4>H3ZO4,则下列判断错误的是 ( )
| A.原子半径X>Y>Z | B.气态氢化物的稳定性HX>H2Y>ZH3 |
| C.非金属性X>Y>Z | D.阴离子的还原性Z3->Y2->X- |