甲烷燃料电池,分别选择H2SO4溶液和NaOH溶液做电解质溶液,下列有关说法正确的是
| A.总反应方程式式都为CH4+2O2===CO2+2H2O |
| B.H2SO4和NaOH的物质的量都不变,但浓度都减小 |
| C.若用H2SO4溶液做电解质溶液,负极反应式为CH4-4e-+H2O===CO2+4H+ |
| D.若用NaOH溶液做电解质溶液,正极反应式为O2+2H2O+4e-===4OH- |
某有机物的结构为下图所示,这种有机物不可能具有的性质是( )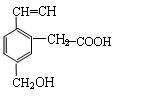 []
[]
①可以燃烧;②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应; ④能发生酯化反应;
⑤能发生加聚反应;⑥能发生水解反应
| A.①④ | B.只有⑥ | C.只有⑤ | D.④⑥ |
在人们的印象中,塑料是常见的绝缘材料,但2000年三名诺贝尔化学奖得主的研究成果表明,塑料经改造后能像金属一样具有导电性,要使塑料聚合物导电,其内部的碳原子之间必须交替地以单键和双键结合(再经掺杂处理).目前导电聚合物已成为物理学家和化学家研究的重要领域.由上述分析,下列聚合物经掺杂处理后可以制成“导电塑料”的是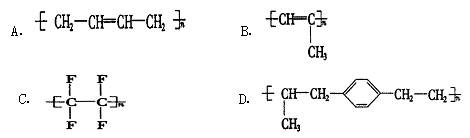
下列关于煤、石油、天然气等资源的说法正确的是
| A.煤的气化和液化过程只发生物理变化 |
| B.天然气作为化工原料主要用于合成氨和生产甲醇 |
| C.石油分馏的目的是生产乙烯、丙烯、甲烷等化工原料 |
| D.天然气和液化石油气的主要成分是甲烷 |
含有元素硒(Se)的保健品已走进人们的生活之中,已知它与氧同主族,而与钙同周期,下列关于硒的有关描述中错误的是
| A.它位于周期表第四周期第VIA族 |
| B.最高价氧化物为SeO2,为酸性氧化物 |
| C.原子半径比钙小 |
| D.气态氢化物化学式为H2Se |
下列叙述中,甲金属的活泼性肯定比乙金属的活泼性强的是
| A.甲原子的最外层电子数比乙原子的最外层电子数少 |
| B.甲原子电子层数比乙原子的电子层数多 |
| C.1mol 甲从酸中置换出的H2比1 mol 乙从酸中置换出的H2多 |
| D.常温时,甲能从水中置换出氢,而乙不能 |