下列各图叙述正确的是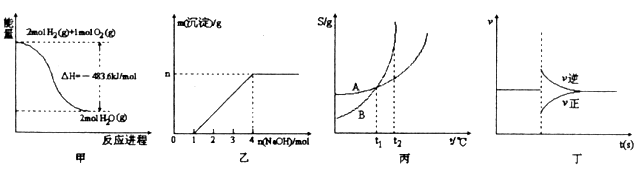
A.图甲表示H2与O2发生反应过程中的能量变化,H2的燃烧热为241.8kJ/mol;
B.图乙表示某澄清透明溶液中只可能含有①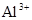 ;②
;②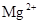 ;③
;③ ;④
;④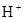 ;⑤
;⑤ ;⑥
;⑥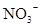 中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。该溶液中一定含有的离子是②④⑥;
中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。该溶液中一定含有的离子是②④⑥;
C.图丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A;
D.图丁曲线可以表示对某化学平衡体系改变温度后反应速率随时间的变化。
已知:2H2(g) +O2(g) =2H2O( l )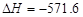 kJ·mol-1
kJ·mol-1
CH4(g) +2O2(g) =CO2(g) +2H2O( l ) kJ·mol-1
kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O( l ),若实验测得反应放热3695 kJ,则原混合气体中H2与CH4的物质的量之比是
| A.1:1 | B.1:3 | C.1:4 | D.2:3 |
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热 kJ/mol,则H2SO4和Ca(OH)2反应的中热 kJ/mol,则H2SO4和Ca(OH)2反应的中热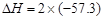 kJ/mol kJ/mol |
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的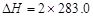 kJ/mol kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
“熵”可看作是“混乱度”,它的符号是“S”。下列变化中,△S<0(“混乱度”减小)的是
| A.3Fe(s)+4H2O(g) =Fe3O4(s)+4H2(g) |
| B.2NO2(g) =N2O4(l) |
| C.2IBr(l) =I2(s)+Br2(g) |
| D.(NH4)2CO3(s) =2NH3(g)+CO2(g)+2H2O(g) |
100 mL 6 mol/L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速度,但又不影响生成氢气的总量,不可向反应物中加入适量的
| A.碳酸钠(固体) | B.水 |
| C.硫酸钾溶液 | D.CH3COONa(固体) |
已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中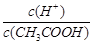 值增大,可以采取的措施是
值增大,可以采取的措施是
| A.加少量烧碱溶液 | B.降低温度 |
| C.加少量冰醋酸 | D.加水 |