某铅酸蓄电池的工作原理如图所示,其总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列判断不正确的是( )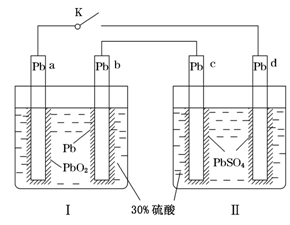
| A.闭合K时,d电极的反应式为PbSO4+2H2O-2e-=PbO2+4H++SO42— |
| B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol |
| C.闭合K时,Ⅱ中SO42—向c电极迁移 |
| D.闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极 |
2011年央视3·15特别节目《“健美猪”真相》的报道,将我
国最大肉制品加工企业双汇集团卷入“瘦肉精”漩涡之中。盐酸克伦特罗(即瘦肉精的一种)学名7 – [2 – 甲基丙烷 – 2 – 亚氯基 – 甲基] – 4 – 氨基 – 3,5 – 二氯苯甲醇盐酸盐,是白色或类白色的结晶粉末,无臭,熔点161℃,微溶于丙酮,不溶于乙醚;其结构简式如右。则下列有关说法正确的是()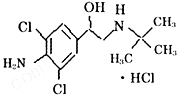
| A.该化合物的分子式C12H18Cl2N2O·HCl |
| B.1mol的该化合物能与2mol的NaOH反应 |
| C.该化合物难溶于水 |
| D.该化合物受热易分解,所以只要将猪肉长时间焖煮即可安全食用 |
下列反应的离子方程式正确的是()
右图是298K、101kPa时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是()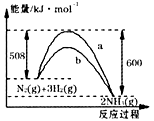
A.该反应的热化学方程式为: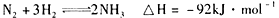 |
| B.a曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热改变 |
| D.在温度、体积一定的条件下,通入1molN2和3molH2反应后 |
放出的热量为Q1kJ,若通入2molN2和6molH2反应后放出的热量
为Q2kJ,则184kJ·mol-1>Q2>2Q1
不能实现下列物质间直接转化的元素的是()
| A.铜 | B.硫 | C.钠 | D.碳 |
用NA表示阿伏加德罗常数的值,下列说法正确的是()
| A.标准状况下,22.4LNO和11.2L O2的混合气体中所含分子数为NA |
| B.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数为1.5NA |
| C.1mol氯气与足量氢氧化钠溶液反应时转移的电子数为2NA |
| D.常温常压下,20克H218O所含中子数为12NA |