已知:
①25℃时弱电解质电离平衡数;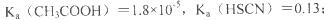
难溶电解质的溶度积常数: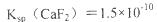
②25口C时,2×l0 mol
mol 氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、c(F-)与溶液pH的变化关系,如下图所示:
氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、c(F-)与溶液pH的变化关系,如下图所示: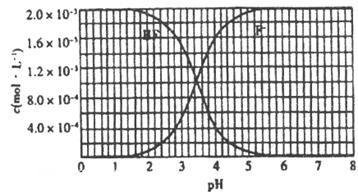
请根据以下信息回答下列问题:
(1) 25℃时,将20mL 0.10 mol 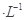 CH3COOH溶液和20mL O.l mol
CH3COOH溶液和20mL O.l mol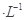 HSCN溶液分别与20mL 0.10 mol
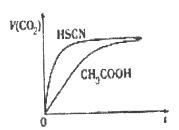
HSCN溶液分别与20mL 0.10 mol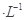 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为上图所示:
NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为上图所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因
是_____________________________________________________________,
反应结束后所得两溶液中,C(CH3COO-)_______c(SCN-)(填“>”、“<”或“=”)
(2) 25℃时,HF电离平衡常数的数值Ka≈_________。
(3)4×10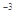 mol
mol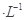 HF溶液与4×10
HF溶液与4×10 mol·
mol·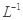 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
用“大于”或“小于”或“等于”回答下列问题:
(1)酸性:H2CO3H2SiO3, H2SiO3H3PO4
(2)碱性:Ca(OH)2Mg(OH)2, Mg(OH)2Al(OH)3
(3)气态氢化物稳定性:H2OH2S, H2SHCl
(4)还原性: H2OH2S, H2SHCl
(5)酸性: H2SO4H2SO3, HClO4HClO
从以上答案中可以归纳出:
①元素的非金属性越强,其对应最高价氧化物水化物的酸性越;
②元素的金属性越强,其对应最高价氧化物水化物的碱性越。
、4g甲烷在氧气中燃烧生成二氧化碳和液态水,放出222.5KJ热量,写出甲烷燃烧的热化学方程式
有下列各组微粒或物质:
A、O2和O3B、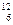 C和
C和 C C、CH3CH2CH2CH3和
C C、CH3CH2CH2CH3和
(1)组两种微粒互为同位素;
(2)组两种物质互为同素异形体;
(3)组两物质互为同分异构体;
(4)组两物质是同一物质。
下列反应中,属于放热反应的是,属于吸热反应的是
①食物在空气中腐败②生石灰与水作用制熟石灰③碳和二氧化碳化合生成CO ④酸与碱中和反应⑤加热KClO3和MnO2的混合物制O2⑥将氯化铵晶体和氢氧化钡晶体混合均匀放在日光下暴晒
由以下一些微粒: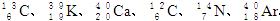 。其中:
。其中:
(1)互为同位素的是________和________;
(2)质量数相等,但不能互称同位素的是________和__________;
(3)中子数相等,但质子数不相等的是______和____ _、______和___ _。