如图为反应2H2(g)+O2(g) 2H2O(g)的能量变化示意图。下列说法正确的是
2H2O(g)的能量变化示意图。下列说法正确的是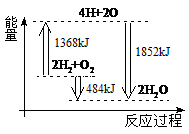
| A.拆开2 mol H2(g)和1 mol O2(g)中的化学键成为H、O原子,共放出1368 kJ能量 |
| B.由H、O原子形成2 mol H2O(g),共吸收1852 kJ能量 |
| C.2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),共吸收484 kJ能量 |
| D.2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),共放出484 kJ能量 |
四氯化碳是重要的有机溶剂。下列关于四氯化碳的性质说法正确的是
| A.常温常压下为气体 | B.密度比水小 |
| C.属于烃类化合物 | D.难溶于水 |
下列化学用语正确的是
| A.氯化钠的电子式: Na+Cl- |
| B.乙烯的结构式:H-C=C-H |
C.磷原子的结构示意图 |
| D.纤维素的化学式:(C6H10O5)n |
下列各组物质与概念之间的关系,不符合右图所示的是
| A |
B |
C |
D |
|
| 物质(X) |
Al(OH)3 |
苛性钠 |
漂白粉 |
乙醇 |
| 概念(Y) |
两性氢氧化物 |
碱 |
混合物 |
电解质 |

下列各组物质互为同素异形体的是
| A.168O和188O | B.正丁烷和异丁烷 |
| C.CH4和C3H8 | D.金刚石和石墨 |
下列物质中只含有离子键的是
| A.SiO2 | B.NaOH | C.MgBr2 | D.HCl |