部分弱酸的电离平衡常数如下表:
| 弱酸 |
HCOOH |
HCN |
H2CO3 |
| 电离平衡 常数(25℃) |
Ki=1.77×10-4 |
Ki=4.9×10-10 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项正确的是 ( )。
A.2CN-+H2O+CO2=2HCN+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.等浓度的HCOONa和NaCN溶液的pH前者大于后者
D.中和等浓度的HCOOH和HCN消耗NaOH的量前者等于后者
下列叙述正确的是 ( )。
| A.在常温下,无论是纯水,还是酸性、碱性或中性稀溶液中,c(H+)·c(OH-)=1×10-14 |
| B.c(H+)=1×10-7 mol·L-1的溶液一定是中性溶液 |
| C.0.2 mol·L-1 CH3COOH溶液中的c(H+)是0.1 mol·L-1 CH3COOH溶液中的c(H+)的2倍 |
| D.任何浓度的溶液都可以用pH来表示其酸碱性的强弱 |
对于可逆反应N2(g)+3H2(g)  2NH3(g);ΔH<0,下列研究目的和示意图相符的是 ( )。
2NH3(g);ΔH<0,下列研究目的和示意图相符的是 ( )。
| A |
B |
|||
| 研究 目的 |
压强对反应的影 响(p2>p1) |
温度对反应的影响 |
||
| 图示 |
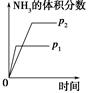 |
 |
||
| C |
D |
|||
| 研究 目的 |
平衡体系增加N2 对反应的影响 |
催化剂对反应的影响 |
||
| 图示 |
 |
 |
||
下列关于平衡常数的说法中,正确的是 ( )。
| A.在平衡常数表达式中,反应物浓度用起始浓度表示,生成物浓度用平衡浓度表示 |
| B.化学平衡常数较大的可逆反应,所有反应物的转化率一定大 |
| C.可以用化学平衡常数来定量描述化学反应的限度 |
| D.平衡常数的大小与温度、浓度、压强、催化剂有关 |
可逆反应mA(g)+nB pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是 ( )。
pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是 ( )。
A.若增加B的量,平衡体系颜色加深,说明B必是气体
B.增大压强,平衡不移动,说明m+n一定等于p+q
C.升高温度,A的转化率减小,说明正反应是吸热反应
D.若B是气体,增大A的量,A、B的转化率都增大