下列各溶液中的离子组能大量共存的是 ( )
| A.pH=0的溶液中:K+、Fe2+、C1-、NO3- |
| B.强碱性溶液中:Na+、K+、A1O2-、CO32- |
| C.c(H+)=c(OH-)的溶液中:Na+、Ba2+、C1-、SO42- |
| D.使蓝色石蕊试液变红的溶液中:Na+、K+、SO32-、HCO3- |
下列微粒的结构示意图是表示VIA某元素原子结构示意图的是()
据报道,放射性同位素钬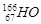 可有效冶疗肝癌,该同位素原子核内的中子数与质子数之差为()
可有效冶疗肝癌,该同位素原子核内的中子数与质子数之差为()
| A.32 | B.67 | C.99 | D.166 |
元素性质呈周期性变化的决定因素是 ( )
| A.元素原子半径大小呈周期性变化 | B.元素原子量依次递增 |
| C.元素原子最外层电子排布呈周期性变化 | D.元素的最高正化合价呈周期性变化 |
在一定温度下,向a L密闭容器中加入1molX气体和2 molY气体,发生如下反应:X(g) + 2Y(g)  2Z(g) 此反应达到平衡的标志是()
2Z(g) 此反应达到平衡的标志是()
| A.正反应和逆反应的速率都为零 |
| B.容器内各物质的浓度不随时间变化 |
| C.容器内X、Y、Z的浓度之比为1∶2∶2 |
| D.单位时间消耗0.1molX同时生成0.2molZ |
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
下列描述正确的是( )
| A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s) |
| B.反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C.Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+ Y(g) Z(g) Z(g) |