已知在298K时下述反应的有关数据:C(s)+1/2O2(g) ="==" CO(g) △H1 = -110.5 kJ• mol-1
C(s)+O2(g) ="==" CO2(g) △H2= -393.5 kJ• mol-1 则C(s)+CO2(g) ="==" 2CO(g) 的△H 为
| A.+283.5 kJ• mol-1 | B.+172.5 kJ• mol-1 | C.-172.5 kJ• mol-1 | D.-504 kJ• mol-1 |
具有相同分子式的一溴代烷,其水解后的产物在红热铜丝催化下,最多可能被氧化成四种不同的醛,则该一溴代烷的分子式可能是
| A.C3H7Br | B.C4H9Br | C.C5H11Br | D.C6H13Br |
有机物丁香油酚结构简式为: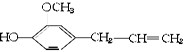 其可能具有的性质是:
其可能具有的性质是:
①能发生加成反应,②能使酸性高锰酸钾溶液褪色,③能发生取代反应,④能与三氯化铁发生显色反应,⑤能发生中和反应,⑥能发生消去反应
| A.全部 | B.仅①②③④ | C.除⑥外都能 | D.除④⑥外都能 |
中草药秦皮中含有的七叶树内酯 (碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用。若1mol 七叶树内酯,分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为
(碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用。若1mol 七叶树内酯,分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为
| A.3mol Br2;2mol NaOH | B.3mol Br2;4mol NaOH |
| C.2mol Br2;3mol NaOH | D.4mol Br2;4mol NaOH |
化学工作者从反应:C3H8(g)+Cl2(g)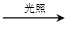 C3H7Cl(l)+HCl (g)受到启发,提出在有机合成工业和农药上可获得副产品盐酸,这一设想已成为现实,试指出从上述反应体系中得到盐酸可采用的分离方法是
C3H7Cl(l)+HCl (g)受到启发,提出在有机合成工业和农药上可获得副产品盐酸,这一设想已成为现实,试指出从上述反应体系中得到盐酸可采用的分离方法是
| A.蒸馏法 | B.水洗法 | C.分液法 | D.过滤法 |
1993年由中国学者和美国科学家共同合成了世界上最大的碳氢分子,其一个分子由1334 个碳原子和1148个氢原子构成关于此物质,下列说法肯定错误的是
| A.属烃类化合物 | B.常温下是固态 |
| C.可发生氧化、加成反应 | D.可能含381个碳碳叁键 |