白磷与氧可发生如下反应:P4+5O2="==" P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P:a kJ·mol-1、P-O:b kJ·mol-1、P=O:c kJ·mol-1、O=O:d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的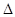 H,其中正确的是
H,其中正确的是
| A.(6a+5d-4c-12b) kJ·mol-1 | B.(4c+12b-6a-5d) kJ·mol-1 |
| C.(4c+12b-4a-5d) kJ·mol-1 | D.(4a+5d-4c-12b) kJ·mol-1 |
某有机物的结构简式为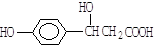 ,它可以发生的反应类型有
,它可以发生的反应类型有
(a)取代 (b)加成 (c)消去 (d)酯化 (e)水解 (f)中和 (g)加聚
| A.(a)(c)(d)(f) | B.(b)(e)(f)(g) | C.(a)(b)(c)(d)(g) | D.除(e)(g)外 |
下列反应中,属于取代反应的是
①CH3CH=CH2+Br2 CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CHO+2Ag(NH3)2OH 2Ag↓+CH3COONH4+3NH3+H2O
2Ag↓+CH3COONH4+3NH3+H2O
③CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3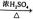 C6H5NO2+H2O
C6H5NO2+H2O
| A.①② | B.③④ | C.①③ | D.②④ |
目前工业上用乙烯制乙醛的过程分为三步进行:
①CH2=CH2+PdCl2+H2O → CH3CHO+2HCl+Pd
②Pd+2CuCl2= PdCl2+2CuCl
③2CuCl+1/2O2+2HCl=2CuCl2+H2O
对于整个生产过程,下列叙述正确的是
| A.CH2=CH2是还原剂,PdCl2是氧化剂 |
| B.CuCl是还原剂,O2是氧化剂 |
| C.乙烯是还原剂,O2是氧化剂 |
| D.Pd和CuCl都是催化剂 |
下列反应的化学方程式(或离子方程式)错误的是
A.乙醛与银氨溶液反应 CH3CHO+2[Ag(NH3)2]OH  CH3COONH4+2Ag↓+3NH3+H2O CH3COONH4+2Ag↓+3NH3+H2O |
B.酯的水解反应 CH3CH2OOCCH3+H218O  CH3CH2OH+CH3CO18OH CH3CH2OH+CH3CO18OH |
| C.苯酚与氢氧化钠溶液反应 C6H5OH+OH—→ C6H5O—+H2O |
| D.醋酸溶解水垢(主要成分是碳酸钙)CO32-+CH3COOH →CO2↑+CH3COO-+H2O |
 需经过下列哪种合成途径( )。
需经过下列哪种合成途径( )。
| A.消去→加成→消去 | B.加成→消去→脱水 |
| C.加成→消去→加成 | D.取代→消去→加成 |