1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
| A.该合金中铜与镁的物质的量之比是2∶1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 ml |
相同体积,相同PH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是()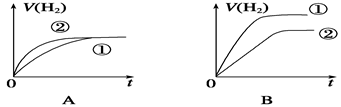
已知反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 ( )
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 ( )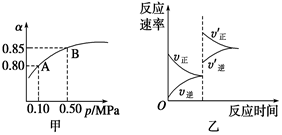
| A.由图甲知,A点SO2的平衡浓度为0.4 mol/L |
| B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2 |
| C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
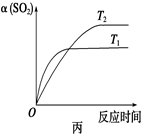
| D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
对于平衡体系mA(g)+nB(g)  pC(g)+qD(g) ΔH<0,有下列判断,其中正确的是( )
pC(g)+qD(g) ΔH<0,有下列判断,其中正确的是( )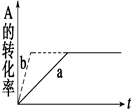
A.若温度不变,将容器的体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时A、B的物质的量之比为m∶n
C.若平衡体系共有气体a mol,再向其中加入b mol B,当 重新达到平衡时,气体的总物质的量等于(a+b),则m+n>p+q
D.加催化剂或增大压强,可实现右图中a―→b的变化
某温度下的定容密闭容器中,进行可逆反应:A(s)+2B(g) C(g)+D(g),当下列物理量不发生变化时:①混合气体的密度②容器内气体的压强③混合气体的平均相对分子质量④B的物质的量浓度能表明该反应一定已达到平衡状态的是()
C(g)+D(g),当下列物理量不发生变化时:①混合气体的密度②容器内气体的压强③混合气体的平均相对分子质量④B的物质的量浓度能表明该反应一定已达到平衡状态的是()
| A.①③④ | B.②③ | C.②③④ | D.只有④ |
向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO(g)+H2O(g) CO2(g)+H2(g)。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
CO2(g)+H2(g)。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
| A.0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2 |
| B.1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2 |
| C.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 molH2 |
| D.0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2 |