(10分)已知某溶液中存在OH-、H+、NH4+ 、Cl- 四种离子。某同学推测其离子浓度大小顺序有如下关系:
①.c(Cl-)>c(NH4+ )>c(H+)>c(OH-) ②.c(Cl-)>c(NH4+ )>c(OH-)>c(H+)
③.c(NH4+ )>c(Cl-)>c(OH-)>c(H+) ④.c(Cl-)>c(H+)>c(NH4+ )>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是_____________________(填化学式)上述四种离子浓度的大小关系为_____________(填序号)
(2)若上述关系中③是正确的,则溶液中的溶质为_____________________(填化学式)
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)______________c(OH-)
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有10个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A , C,D,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:。
(3)写出A、B两元素的最高价氧化 物的水化物之间的相互反应的化学方程式:。
物的水化物之间的相互反应的化学方程式:。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)
由铜、锌和稀硫酸组成的原电 池中,正极是_______,发生______________,电极反应是________________;负极是_______,发生_____________,电极反应是_______,电子的流动方向是从极到极;电流方向是从
池中,正极是_______,发生______________,电极反应是________________;负极是_______,发生_____________,电极反应是_______,电子的流动方向是从极到极;电流方向是从 极到极。
极到极。
下列各项分别与哪个影响化学反应速率的因素的关系最为密切?
(1)硫在氧气中比在空气中燃烧 剧烈______________
剧烈______________
(2) MnO2加入双氧水中反应更剧烈______________
(3)同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完___________
(4) 镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生________
根据下列叙述,画出对应1--3的微粒结 构示意图:
构示意图:
(1)A元素原子的最外层电子数为电子层数的3倍:。
(2)与Ar原子电子层结构相同的-1价阴离子:。
(3)质量数为23,中子数为12的原子。
(4)写出下列物质的名称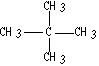 ___________
___________
(5)C5H12的同分异构体有种
(8分)X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气),Y+Z→B(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是;
②生成固体C的化学方程式是。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①A的化学式是;
②向苛性钠溶液中通入过量的B,所发生反应的离子方程式是;