利用下图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是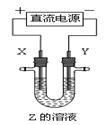
| A.氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠 |
| B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 |
| C.电镀工业中,X是待镀金属,Y是镀层金属 |
| D.外加电流的阴极保护法中,Y是待保护金属 |
下列化学用语及相关事实不正确的是()
| A.碱性氢氧燃料电池的正极反应:H2 - 2e- + 2OH-="==" 2H2O |
B.用电子式表示NaCl的形成过程: |
| C.某反应的ΔH=+100 kJ·mol-1,则正反应活化能不小于100 kJ·mol-1 |
| D.以Al作阳极电解稀硫酸,使铝表面的氧化膜增厚。阳极反应:2Al+3H2O-6e=Al2O3+6H+ |
下述实验方案能达到实验目的的是()
| 选项 |
A |
B |
C |
D |
| 实验 方案 |
  食盐水 |
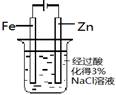 片刻后在Fe电极附近 滴入K3[Fe(CN)6]溶液 |
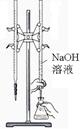 |
 |
| 实验 目的 |
验证铁钉发生了 析氢腐蚀 |
验证Fe电极被保护 |
用已知浓度的氢氧化钠溶液测定未知浓度盐酸 |
检查装置气密性 |
下列说法正确的是()
①原子都是由质子、中子和电子组成
②在天然存在的各种元素中,无论是游离态还是化合态,各种核素所占的原子百分比一般是不变的
③由非金属元素组成的化合物一定是共价化合物;由两种元素组成的共价化合物分子中只存在极性键
④元素金属性越强,对应单质的还原性一定越强;元素非金属性越强,对应单质的氧化性一定越强
⑤稀有气体元素原子序数越大其单质的沸点一定越高,稀有气体形成的固体中无化学键,只有范德华力
⑥含有离子键的化合物一定是离子化合物,含有共价键的化合物未必是共价化合物
| A.①②③④ | B.②④⑤⑥ | C.②⑤⑥ | D.全部正确 |
设NA是阿伏加德罗常数的数值,下列说法正确的是()
| A.58.5g NaCl晶体中含有共价键数为NA |
| B.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
| C.1 molFe(OH)3胶体微粒所含的Fe(OH)3分子数大于NA |
| D.1 L 1mol·L-1的NaAlO2水溶液中含有的氧原子数为2NA |
下列有关说法正确的是()
| A.焓变就是反应热,化学变化中存在焓变,物理变化中不存在焓变。 |
| B.电解池中与直流电源正极相连的是阳极,阳极发生氧化反应;与电源负极相连的是阴极,阴极发生还原反应。通电时,电子的流向为负极→阴极→电解质→阳极→正极 |
| C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1 |
| D.CO(g)的燃烧热是ΔH=-283.0 kJ·mol-1,则反应CO2(g)===CO(g)+1/2O2(g)的反应热ΔH=+283.0 kJ·mol-1 |