配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的是
①定容时观察液面仰视; ②定容时观察液面俯视 ③有少量NaOH溶液残留在烧杯中
④容量瓶中原来有少量蒸馏水 ⑤把配好的溶液倒入用蒸馏水洗净而末干的试剂瓶中备用
| A.②④⑤ | B.②③④ | C.①③⑤ | D.③④⑤ |
下列各项表达中正确的是()
| A.乙烯的结构简式为CH2CH2 |
| B.84g碳酸镁和碳酸氢钠的混合物与足量盐酸反应生成CO2的体积在标准状况下为22.4L |
| C.常温常压下28g氮气所含电子数约为6.02×1024 |
D.Cl—的结构示意图为 |
用惰性电极电解硫酸铜溶液一段时间后,向电解池中加入0.2molCu(OH)2恰好恢复为电解前的浓度,则电解过程中转移电子的物质的量为
| A.0.8 mol | B.0.4 mol | C.0.2mol | D.0.6mol |
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如下图所示的原电池。
2Fe2++I2设计成如下图所示的原电池。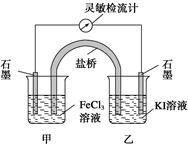
下列判断不正确的是
| A.反应开始时,乙中石墨电极上发生氧化反应 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.检流计读数为零时,反应达到化学平衡状态 |
| D.检流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极 |
铁镍蓄电池放电时的总反应为:Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O |
已知:N2(g)+3H2(g) ===2NH3(g) ΔH=-92.4 kJ·mol-1下列说法正确的是
| A.反应中的能量变化如图所示,则ΔH=E1-E3 |
| B.若加入催化剂,将改变反应历程,从而改变ΔH |
| C.温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 |
| D.若保持温度和容器体积不变,充入氦气,则压强增大,化学反应速率加快 |