食盐是日常生活的必需品,也是重要的化工原料。
粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳。实验室提纯NaCl的流程如下: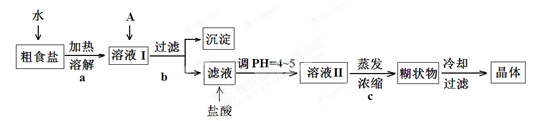
(1) 欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出A所代表的多种试剂,按滴加顺序依次为i NaOH i iii 。(填化学式)
(2)请写出下列试剂加入时发生反应的离子反应方程式:
加入试剂i: ;加入试剂iii: 。
(3)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为 。(从提供的试剂中选)
(4)实验中用到的盐酸的物质的量浓度为0.400mol/L,现实验室某浓盐酸试剂瓶上的有关数据如下:
欲用上浓盐酸配制实验所需浓度的稀盐酸480ml,
①配制需要的玻璃仪器有 (填仪器名称)。
②需量取的浓盐酸的体积为: 。
(10分)某课外活动小组对污染大气的部分非金属氧化物进行探究。请根据题目要求回答下列问题:
(1) 写出用铜与稀硝酸反应制取一氧化氮的离子方程式: ________________
(2)查阅资料 得知:
得知: 。实验室有如图所示的装置.则制取一氧化碳可选用的装置为________________(填字母)。
。实验室有如图所示的装置.则制取一氧化碳可选用的装置为________________(填字母)。
(3)汽车尾气是当前城市大气污染的主要来源之一.汽车尾气中的主要污染物为一氧化碳和氮氧化物。汽车尾气催化转化装置可将这些有害气体转化为无害物质。该小组设计了如图所示的装置(部分夹持装置已略去).在实验室模拟汽车尾气处理的过程。
①实验前关闭K2,打开K1从K1处先通氮气排净装置中的空气,其目的是________
②装置III内发生反应的化学方程式为________
③实验过程中,装置V内可观察到的现象是________________
④实验结束后,关闭K1, 停止加热,打开K2,通入适量空气后,装置IV中可观察到有红棕色气体生成.该气体是________________(填化学式)。
停止加热,打开K2,通入适量空气后,装置IV中可观察到有红棕色气体生成.该气体是________________(填化学式)。
(8分)现有A、B 、C、D、E五种钠盐,它们分别是
、C、D、E五种钠盐,它们分别是 中的某一种。为验证各种物质
中的某一种。为验证各种物质 的具体成分.将固体样品分别配成溶液后进行实验(整个实验不允许使用其他试剂)。
的具体成分.将固体样品分别配成溶液后进行实验(整个实验不允许使用其他试剂)。
( 1)某同学进行了如下实验.请完成实验内容。
1)某同学进行了如下实验.请完成实验内容。
(2)写出B、C两种溶液混合时反应的离子方程式:________________________
我市某化工厂排放的尾气中除含CO2外,还可能含有CO等气体。为确认CO气体是否存在,实验小组利用下列装置进行了检验,请回答下列问题: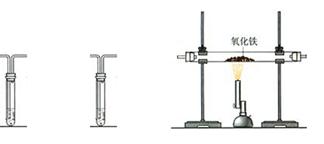
氢氧化钠溶液澄清石灰水
A B C
(1)在实验时,上述装置的连接顺序是:A → B →C→B。其中A装置的作用是,第一次B装置的作用为。
(2)若CO气体存在,则装置C中实验现象为 ,
,
反应的化学方程式为
 (3)从环境保护的角度考虑,你
(3)从环境保护的角度考虑,你 认为该实验的设计该如何改进?请写出一种改进方法:
认为该实验的设计该如何改进?请写出一种改进方法:
。
根据下列实验装置图回答(装 置用代号表示):
置用代号表示):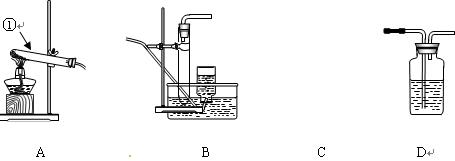
(1)写出编号为①的仪器名称____。
(2)实验室加热高锰酸钾制氧气时,应选用的发生装置是____;实验 室制二氧化碳时,应选用
室制二氧化碳时,应选用 的发生装置是____;检验二氧化碳气体可选用D装
的发生装置是____;检验二氧化碳气体可选用D装 置,其装置中盛放的试剂一般是____。
置,其装置中盛放的试剂一般是____。
(3)实验室加热高锰酸钾制取氧气有以下主要操作步骤:①加热②把药品装入试管后固定在铁架台上③检查装置的气密性④熄灭酒精灯⑤用排水法收集气体⑥从水槽中取出导管。正确的操作顺序是(写序号)____。
(14分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行: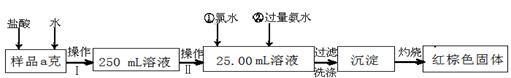
请根据上面流程,回答以下问题:
(1)操作I 所用到的玻璃仪器除烧杯、玻璃棒、量筒外,还必须有(填自选仪器名称),操作II 必须用到的仪器是(从以下选项中选择,填编号)。
| A.50mL烧杯 | B.50mL量筒 | C.25mL碱式滴定管 | D.25mL酸式滴定管 |
(2)加入试剂①和②后发生反应的离子反应方程式为:
(3)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2="0.3" g,则接下来还应进行的操作是____________。
(4) 若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是:。
(5) 有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是:
(用化学方程式表示)