下列有关实验的操作过程,正确的是
| A.钠与水的反应:用镊子从试剂瓶中取出金属钠,用小刀切下绿豆粒大小的一粒钠,小心放入装满水的烧杯中 |
| B.配制100 mL的质量分数10%的H2O2溶液:取一支规格为100 mL的量筒,先取质量分数为30%的双氧水溶液33.3 mL,然后加水至100 mL刻度线 |
| C.检验某浅绿色溶液中含有Fe2+:取该溶液少许,向其中加入KSCN溶液,不变血红色;再向其中滴加氯水,溶液变为血红色 |
| D.取出分液漏斗中所需的上层液体:当下层液体从分液漏斗下端管口流出后及时关闭活塞,然后更换一个接收容器,打开活塞将分液漏斗中的液体放出 |
相同温度下,相同体积的甲、乙两容器,保持体积不变,甲容器中充入1g SO2和1g O2,乙容器中充入2g SO2和2g O2。下列叙述错误的是()
| A.化学反应速率:乙>甲 | B.平衡时O2的浓度:乙>甲 |
| C.平衡时SO2的转化率:乙>甲 | D.平衡时SO2的体积分数:乙>甲 |
一定温度下,能说明反应A(g)+2B(g) 3C(g)已达到平衡状态的是()
3C(g)已达到平衡状态的是()
| A.C的生成速率与C的分解速率相等 |
| B.单位时间内消耗amolA,同时生成3amolC |
| C.容器内压强不再变化 |
| D.混合气体的物质的量不再变化 |
室温下10mL0.1mol/L的醋酸溶液加水稀释后,下列说法正确的是()
| A.溶液中导电粒子的数目减少 |
B.溶液中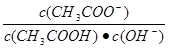 不变 不变 |
| C.醋酸的电离程度增大,c(H+)也增大 |
| D.再加入10mL0.1mol/L的NaOH溶液,混合液的pH=7 |
下列说法或表示方法正确的是()
| A.等质量的硫蒸气和硫磺分别完全燃烧,二者放出的热量一样多 |
| B.氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为 2H2(g)+O2(g)=2H2O(l) ∆H="-285.8" kJ/mol |
| C.2H2(g)+O2(g)=2H2O(l) ∆H=-Q1 kJ/mol 2H2(g)+O2(g)=2H2O(g) ∆H=-Q2 kJ/mol,则Q1>Q2 |
| D.已知中和热为57.3 kJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量等于57.3kJ |
下列说法不正确的是()
| A.用10mL量筒量取6.8mL稀H2SO4 |
| B.用碱式滴定管量取15.80mLKMnO4溶液 |
| C.酸碱中和滴定时,滴定管需用标准液或待测液润洗 |
| D.中和热测定时,氢氧化钠溶液稍过量的目的是为了保证盐酸完全被中和 |